学習院大学,東京大学,早稲田大学は,アルツハイマー病を含むタウオパチーと総称される神経変性疾患の患者脳に観察される特定の変異を持つタウタンパク質が,どのようにして異常な凝集体を形成するのか,その過程を明らかにした(ニュースリリース)。
タウタンパク質は細胞の中に存在し,微小管という細胞の構造を安定させる細胞骨格に結合することが知られている。しかし,アルツハイマー病などの神経変性疾患では,タウタンパク質が異常リン酸化される等により,微小管から離れること,また水溶性の状態から不溶性の塊を作ってしまう。
この異常なタウタンパク質の密な塊(凝集体)が,病気の進行に関与していると考えられているが,タウタンパク質が液体のような状態から固体の塊に変わる過程の研究は十分ではなかった。
研究グループは,この過程を理解するために,青色の光で反応する植物由来のタンパク質の変異体CRY2oligを使ってタウタンパク質の凝集を制御し,その過程を詳細に観察した。
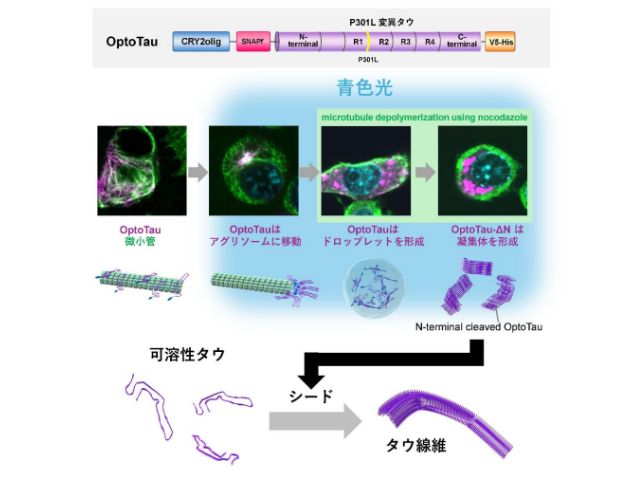
凝集しやすいP301L変異を持つタウタンパク質に光感受性タンパク質CRY2oligを融合させたタウタンパク質OptoTauを使用し,光照射に応答して変化するタウタンパク質の挙動をリアルタイムで操作した。
青色光の照射で,OptoTauは病気で観察されるようなリン酸化状態に変わり,また,細胞内でタウ同士が集まるクラスター形成が促進された。このクラスターは細胞核の周りに集中しており,アグリソームという凝集タンパク質を処理するためのシステムに隔離されていることが観察された。
微小管の形成を阻害する薬でアグリソームを破壊した。実験では,青色光の照射によってOptoTauが細胞全体に散在し,アグリソームではなく膜のない構造体が形成された。
これは,生命科学分野で注目されている液-液相分離で形成されるドロップレットだった。この結果は,タウタンパク質が液滴のような構造から固体の塊に変わる過程が観察されたことを示している。
このOptoTauを真ん中付近で切断したN末端が欠失しているOptoTau-ΔNは,青色光の照射によってOptoTauより強力な凝集体を形成することが分かった。また,これが正常なタウをタウ線維に変換させる種(シード)として機能することが示された。
この結果から,N末端の欠失がタウタンパク質の相互作用を強化し,液滴から安定した凝集体への変化を促進することがわかった。さらにそのタウは,正常なタウを異常凝集タウに変換させることもわかった。
研究グループは,アルツハイマー病などの治療法開発の基礎的知見の蓄積に貢献できる成果だとしている。