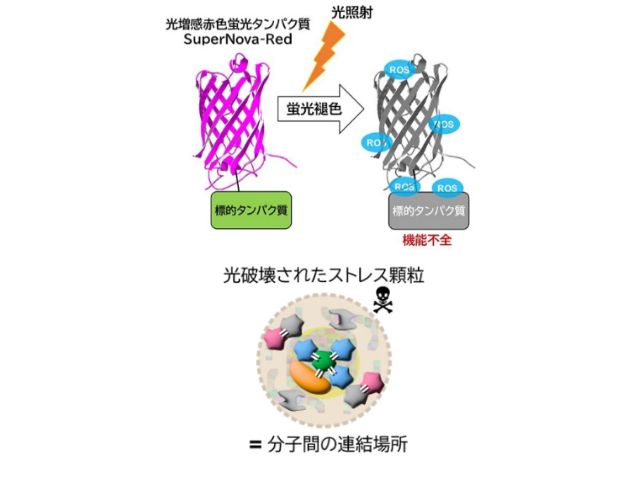
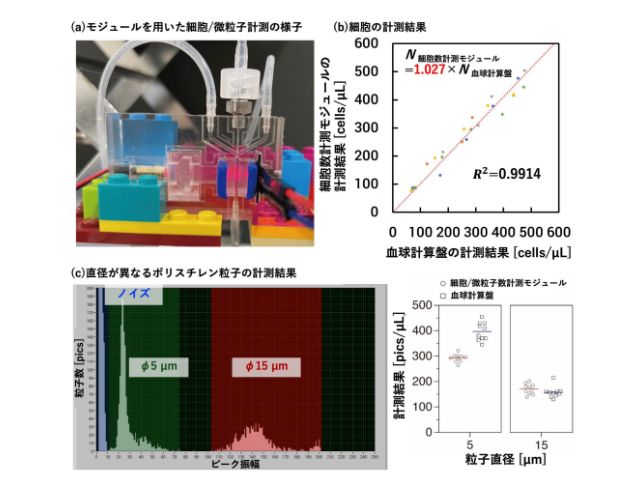
北海道大学の研究グループは,単量体赤色蛍光タンパク質(SuperNova-Red)を細胞内のストレス顆粒へ局在化させた後,光を照射することで,時空間を制御しつつ,ストレス顆粒の機能障害を引き起こすことが可能な光遺伝学法の開発に成功した(ニュースリリース)。
細胞内には様々な凝集体の存在が知られているが,これら区画の特徴的な機能を調べる方法はこれまで確立されていなかった。
研究グループは,まずストレス顆粒に局在するタンパク質であるG3BP1またはTDP-43に,光で起爆できる時限爆弾に相当するSuperNova-Redを融合させて,細胞内に発現させた。
これらの細胞に高塩濃度ストレスを施すことにより,細胞内の原材料供給は維持しつつタンパク質生産経路を抑制し,中間部品の保管部屋と予想されているストレス顆粒という凝集体を形成させた。
次に,ストレスを取り除いて生産経路を元の状態に戻す操作を行なった後,光照射によりこれらの SuperNova-Red時限爆弾を爆発させた。SuperNova-Redからは高反応性の活性酸素種が高効率に産生され,10nm以内程度に近接して存在するタンパク質を機能不全に陥れることができる。
G3BP1型あるいはTDP-43型SuperNova-Red時限爆弾を発現する細胞を,高塩濃度ストレス処理すると,ストレス顆粒を形成する細胞と形成しない細胞が出現した。そこで,高塩濃度ストレスを除去し,ストレス顆粒陰性細胞とストレス顆粒陽性細胞で爆発させた後,10時間にわたり細胞の生存性を顕微鏡下で観察したところ,ストレス顆粒陽性細胞では細胞死率が増加することが分かった。
このことは,ストレス顆粒が細胞の生存性を向上させているという従来の仮説を支持するものとなった。また,G3BP1型爆弾とTDP-43型爆弾の効果を比較すると,G3BP1型爆弾を用いたときに細胞生存性が低くなったことから,ストレス顆粒の機能維持にG3BP1の貢献度が高いことが示唆された。さらに,G3BP1型爆弾を用いると,ストレス顆粒の消失時間が遅延することも分かった。
つまり,機能不全になったストレス顆粒内では,その構成分子が連結されたような状態となっており,この時限爆弾は単に分子を切断して破壊するのではなく,分子同士を連結して機能不全を引き起こしていることが示唆された。
研究グループは,この研究により開発した光遺伝学実験法は,非膜オルガネラ機能の全貌解明や疾患の原因となる凝集体破壊療法のためのツールとなるとしている。