理化学研究所(理研)は,ヒトiPS細胞に対する高効率な蛍光タンパク質導入法を開発した(ニュースリリース)。
生きた細胞の状態を可視化するために,指標(マーカー)となる重要な遺伝子発現を,蛍光または発光タンパク質(レポーター)を用いて可視化する研究開発が広く行なわれている。特にゲノムに直接蛍光タンパク質を組み込むこと(ノックイン)は非常に有効だが,その効率は低くとどまっている。
そこで研究グループは,ノックインされなかった細胞のみを薬剤で除去・選抜し,ノックインされた細胞を高効率に濃縮する手法を開発することを目指した。
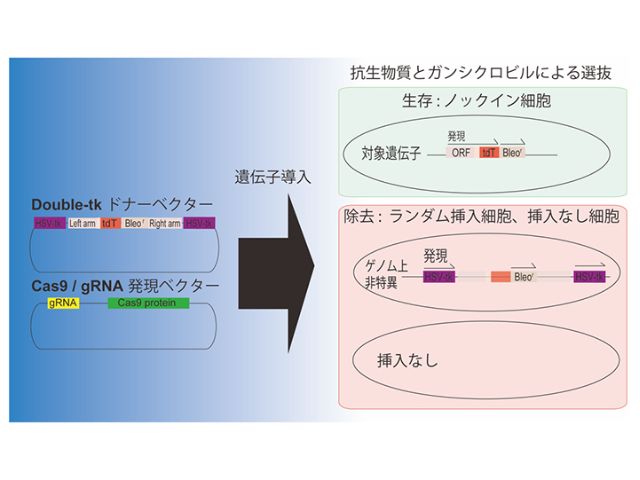
細胞のネガティブセレクションに広く用いられている,単純ヘルペスウイルス由来のチミジンキナーゼ(HSV-tk)とそれに対応する抗ウイルス剤であるガンシクロビル(GCV)のシステムを用いた。
相同組換えを起こす領域の両外側にHSV-tk発現カセットを搭載するドナーベクター(「Double-tkドナーベクター」)を開発し,ドナーベクターがランダムに組み込まれた細胞がGCVによって確実に除去されるようにした。
この手法でヒトiPS細胞の多能性マーカーとして知られるOCT3/4(POU5F1)遺伝子に対して,赤色蛍光タンパク質の一種であるtdTomatoをレポーターとして発現させるノックインシステムを構築した。
このシステムを用いた実験により,GCVでノックインされたiPS細胞を濃縮できること,単一細胞に由来するノックインiPS細胞クローン株の取得が容易になることが判明した。
これらのiPS細胞クローン株を運動神経細胞へと分化させると,tdTomatoの蛍光発現が観察できた。心筋細胞で特異的に発現するMYH7遺伝子に対しても,同様にDouble-tkドナーベクターとGCVを用いることで,レポーターとなる蛍光タンパク質をノックインしたヒトiPS細胞を濃縮でき,効率的に単一細胞に由来するクローン株を取得できることが分かった。
研究グループは,この研究成果は,ヒトiPS細胞を用いた細胞・発生生物学的研究,創薬におけるタンパク質発現を指標とした薬剤候補評価系の構築,再生医療に向けた細胞製造法の確立に貢献すると期待できるとしている。