 東京大学と名古屋工業大学は,クライオ電子顕微鏡を用いてカリウムチャネルロドプシンの立体構造決定に成功した(ニュースリリース)。
東京大学と名古屋工業大学は,クライオ電子顕微鏡を用いてカリウムチャネルロドプシンの立体構造決定に成功した(ニュースリリース)。
光刺激によってイオンを輸送する膜タンパク質であるチャネルロドプシンは,実験動物の神経活動を生きたまま光制御する「光遺伝学ツール」として広く利用されてきた。
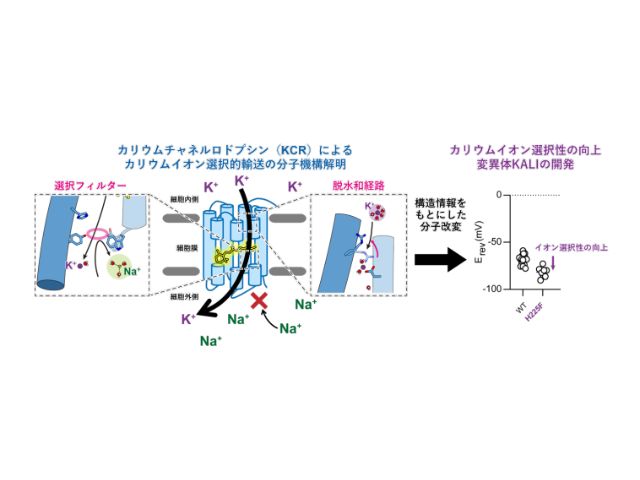
近年カリウムイオンを選択的に輸送するカリウムチャネルロドプシン(KCR)が発見され,神経活動を抑制する理想的な光遺伝学ツールとして期待されている。しかし,KCRは既知のカリウムイオンチャネルとはあらゆる面で全く異なっており,KCR がどのようにカリウムイオンを選択的に輸送するかは大きな謎となっていた。
研究グループは,クライオ電子顕微鏡を用いて,HcKCR1野生型,HcKCR2野生型,そして構造情報をもとにカリウムイオン選択性を向上させたHcKCR1 H225F変異体(KALI-1)の計3種類の立体構造を分解能2.6Å,2.5Å,2.7Å(1Åは100億分の1m)でそれぞれ決定することに成功した。
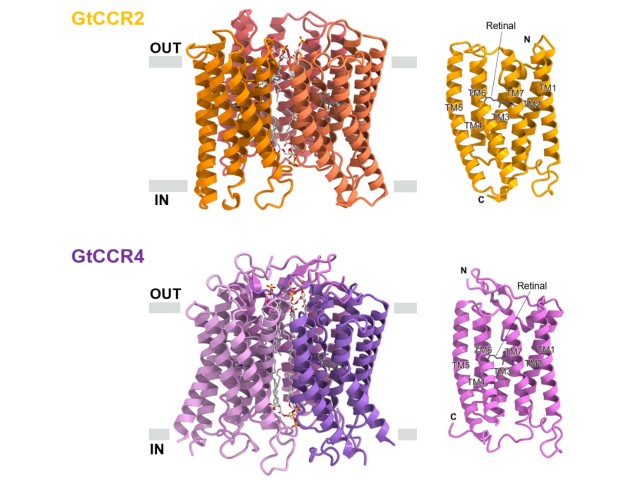
これらのKCRはいずれも単量体内に7本の膜貫通へリックスと光応答を担う発色団を形成するレチナール分子を有し,それぞれ3量体を形成していることが明らかとなった。
また,電気生理学,分光学及び計算科学を組み合わせ,KCRはイオン透過経路の細胞外側に存在するイオン選択フィルター,細胞内側に存在する脱水和システム,そして生理的条件下において形成されるイオン濃度勾配という3要素を利用することで高いカリウムイオン選択性を実現させているという,既知のカリウムイオンチャネルとは全く異なるKCR独自のイオン選択機構を明らかにした。
研究グループは,この研究は生物におけるロドプシンとカリウムイオンチャネルの分子進化に対する理解を促進させただけではなく,この研究において開発されたKALIをはじめとするKCRの有用変異体は,神経科学の発展に貢献し,将来的には光遺伝学を用いた遺伝子治療にも利用されることが期待されるとしている。