 大阪大学の研究グループは,試料を室温に保ったまま核スピンを揃える量子技術「室温超偏極」を用いてNMR(核磁気共鳴)信号を700倍以上増大し,創薬に用いられるNMR手法のデモンストレーションに成功した(ニュースリリース)。
大阪大学の研究グループは,試料を室温に保ったまま核スピンを揃える量子技術「室温超偏極」を用いてNMR(核磁気共鳴)信号を700倍以上増大し,創薬に用いられるNMR手法のデモンストレーションに成功した(ニュースリリース)。
マイクロ波を照射することによって,熱平衡状態の偏極率が炭素核スピンよりも1,000倍以上高い電子スピンと同程度に核スピン偏極率を増大できる動的核偏極(DNP)が注目を集めている。
しかし,熱平衡状態の電子スピンを用いる従来のDNP法で高い偏極率を得るためには,マイナス270℃以下の極低温下で電子スピンの向きを揃えてからDNPを行なう必要があり,装置やその運転にコストがかかっていた。
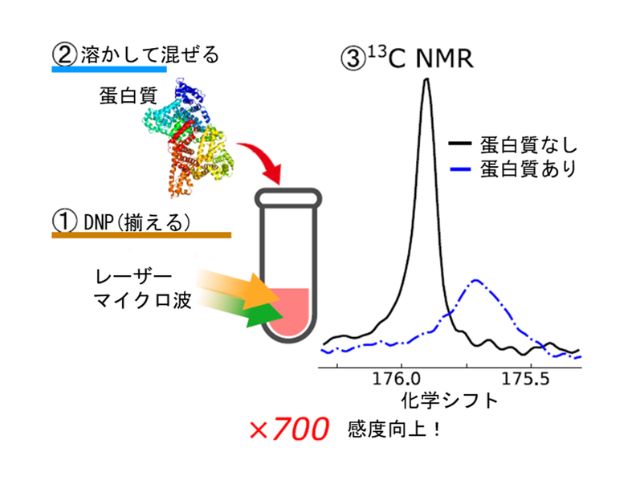
研究グループは,光励起三重項状態の電子スピンを用いたDNP法により,サリチル酸の溶液NMR信号を700倍に高感度化することに成功し,創薬NMR手法に応用した。
ペンタセンなどの有機化合物は,光を照射したとき,量子力学的過程によって電子スピンの向きが温度に関係なく非常に偏った励起三重項状態が現れる。このような分子を試料に少量添加してレーザー光照射後にマイクロ波を照射してDNPを行なえば,温度に関係なく核スピン偏極率を増大できる。
研究グループは,ペンタセンを0.03モル%添加した安息香酸のドメイン(相)とサリチル酸のドメインを持つ共晶状態の試料において,まず室温でトリプレットDNPを用いて試料全体の水素核スピンの偏極率を向上させた。
次に,水素核スピンと13/C核スピンの両方に共鳴する電磁波を与えることで偏極状態を交換する交差偏極現象を引き起こし,3C核スピンの向きを揃えた。
ここまでは低磁場中で行ない,その後試料を高分解能NMR分光のための超伝導磁石の中心に移動させた。そこで,温めた水溶液で試料を溶かし,高偏極化された試料が溶けた後に,高分解能溶液NMR信号を測定した。
この装置は,蛋白質や競合する薬剤を溶かした水溶液をさらに追加注入でき,ヒト血清アルブミンと呼ばれる蛋白質と混ぜた後で測定したNMR信号と比較することで結合の様子を明確に検出した。
高偏極化された分子は蛋白質と結合すると,スピン緩和時間や電子環境が変化することで,NMR信号が広幅になってピーク強度が落ち,化学シフトが変わる。また,サリチル酸よりも強く結合するワルファリンと呼ばれる医薬品有機分子を混ぜた際に,NMR信号によりワルファリンがサリチル酸とHSAの結合を阻害する様子を示す明確なNMR信号の観測にも成功した。
研究グループは,少ない試料での薬剤探索や,精密な情報を得るNMR手法への応用などが今後期待される成果だとしている。