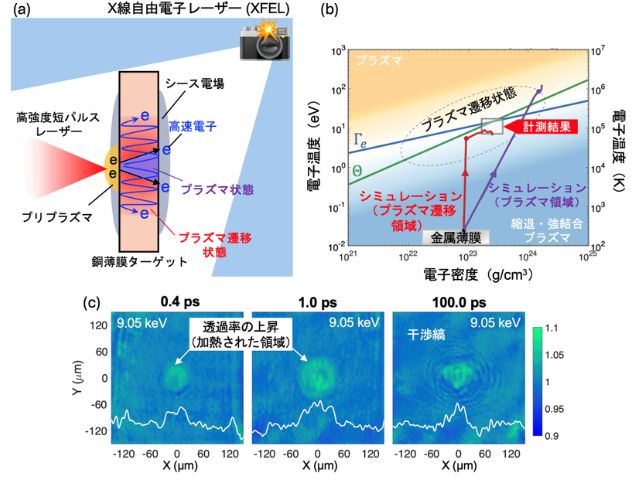
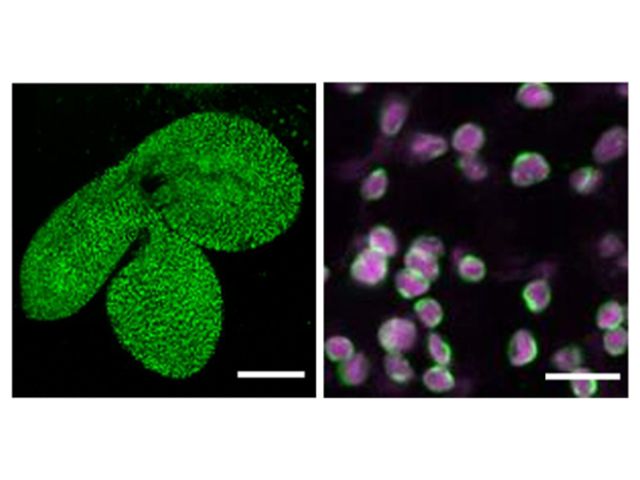
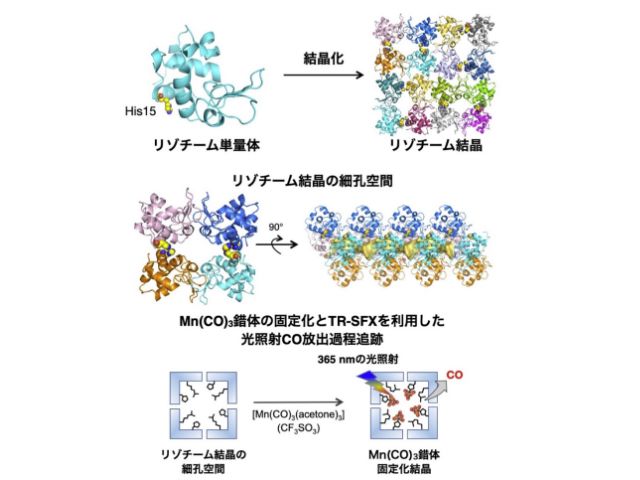
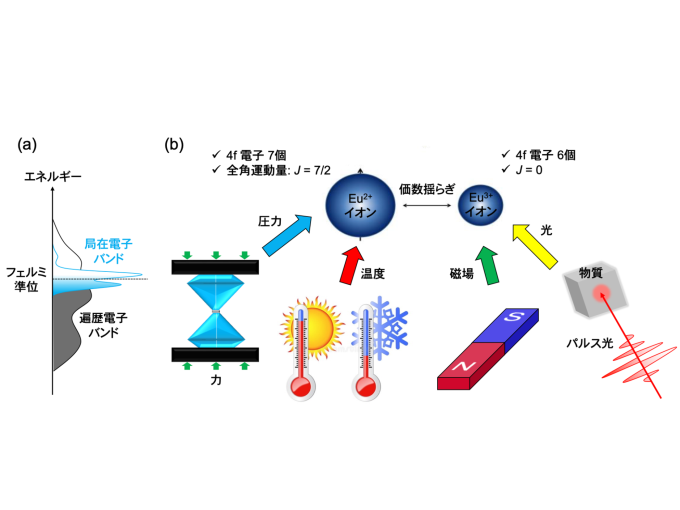
 理化学研究所(理研),京都大学,東北大学,高輝度光科学研究センターは,ビフィズス菌の解糖系酵素の立体構造を常温下で決定し,その酵素の反応メカニズムに関する新たな知見を見いだした(ニュースリリース)。
理化学研究所(理研),京都大学,東北大学,高輝度光科学研究センターは,ビフィズス菌の解糖系酵素の立体構造を常温下で決定し,その酵素の反応メカニズムに関する新たな知見を見いだした(ニュースリリース)。
生体内では酵素群が共同してさまざまな物質やエネルギーを合成することにより,複雑な生命現象が機能している。酵素の反応メカニズムを理解する上で,その形状(立体構造)は重要な情報となる。
近年,酵素の立体構造はX線結晶構造解析やクライオ電子顕微鏡によって解析されているが,これらの手法で得られるのは,放射線損傷を減じるために,−170℃付近の極低温で測定された構造(極低温構造)となる。
従来,この極低温への冷却はタンパク質構造にわずかな影響しか引き起こさないとされてきた。しかし近年の研究により,タンパク質の機能的に重要な可動領域は極低温の影響を特に受けやすく,バイアスのかかった構造を見てしまう可能性があることが示されている。
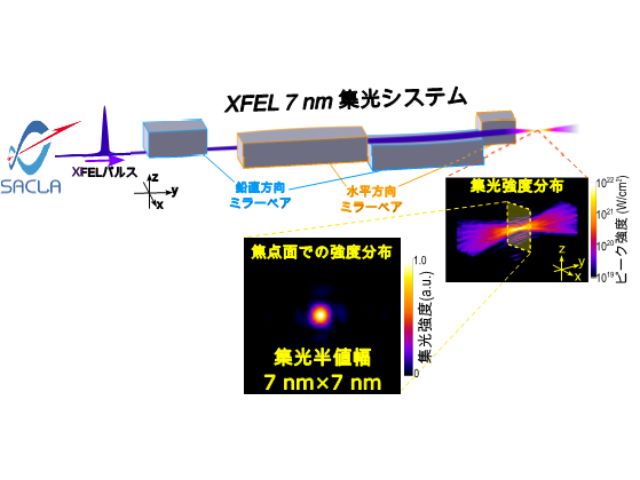
X線自由電子レーザー(XFEL)施設「SACLA」では,連続フェムト秒結晶構造解析(SFX)法により,常温のタンパク質の構造(常温構造)を基本的には放射線損傷の影響を受けることなく観測することができる。
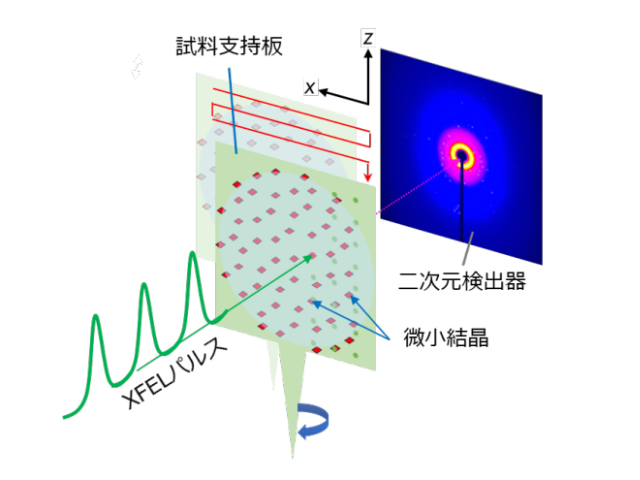
そこで研究では,ビフィズス菌の解糖系酵素であるホスホケトラーゼをターゲットとして,常温構造解析の有用性を見極め,また対象酵素の反応メカニズムに対して新たな知見を得るべく,SACLAにおいてSFX法を実施した。
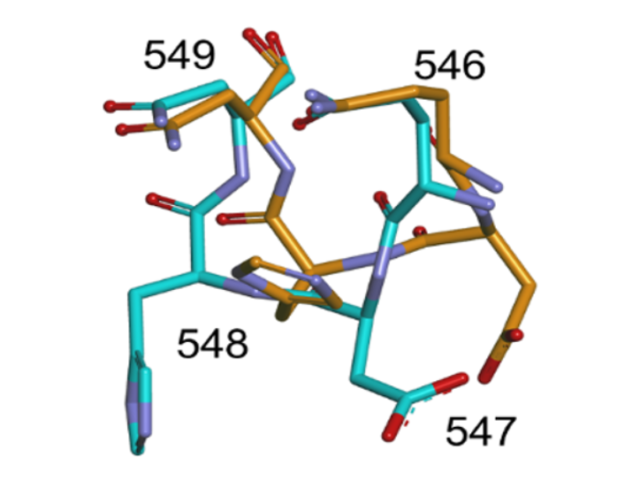
その結果,ホスホケトラーゼの活性部位の入り口に位置する小さなループ状構造が,従来の極低温構造とは異なっていることを発見した。同時に実施した阻害剤との複合体構造の特徴も踏まえた考察により,ホスホケトラーゼの反応メカニズムに関する新たな知見を得ることができた。
解析に必要なホスホケトラーゼの微小結晶は光誘起タンパク質結晶化プレートを用いて取得し,この結晶化法がSACLAでの構造解析の効率化に有効であることも分かった。
タンパク質の極低温構造においては,機能的に重要な可動領域がバイアスのかかった構造をとっている場合があることが,今回の解析により,ホスホケトラーゼについても当てはまることが確認された。
研究グループは今後,SFX法を活用した構造研究を積み重ねることにより,常温・極低温間におけるタンパク質の構造変化のメカニズムの解明がさらに進むとしている。