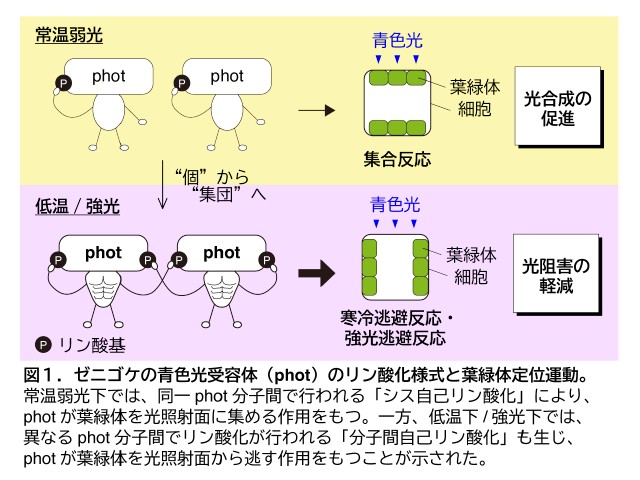
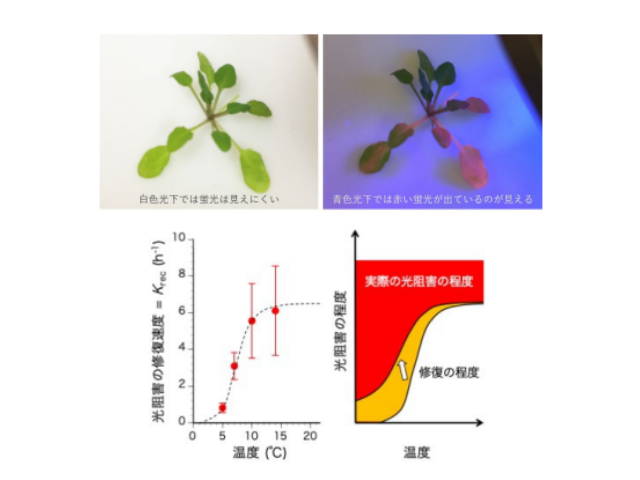
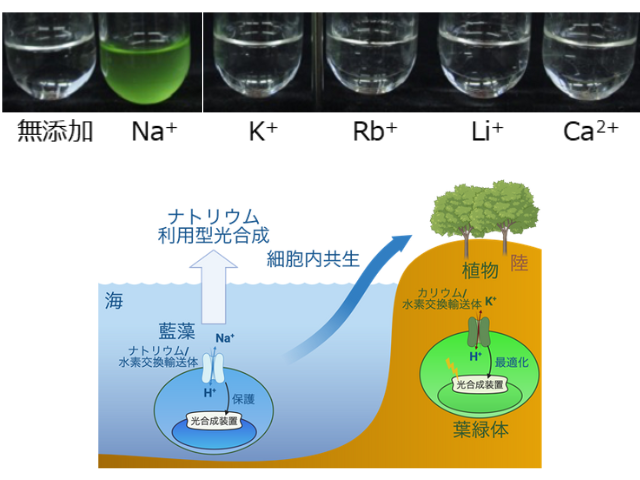
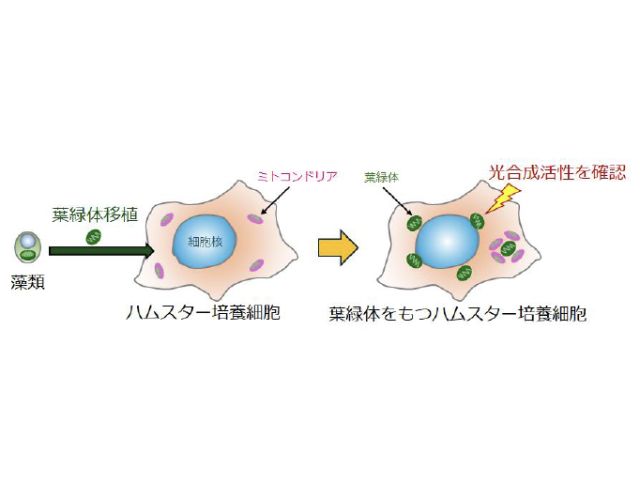
 東京大学の研究グループは,PSIIに含まれる脂質分子に着目し,脂質分子を分解するリパーゼ酵素の働きによって,PSII超複合体が解体されることを明らかにした(ニュースリリース)。
東京大学の研究グループは,PSIIに含まれる脂質分子に着目し,脂質分子を分解するリパーゼ酵素の働きによって,PSII超複合体が解体されることを明らかにした(ニュースリリース)。
光合成を行なう微生物であるシアノバクテリアでは,光合成活性はおよそ200 μmol photons m-2s-1の光強度で最大に達する。太陽からの光強度は,日中に1,000〜2,000 μmol photons m-2s-1に達し,過剰となった光エネルギーは光合成を阻害してしまう。
強光下においては,水を酸素に分解する反応を担う光化学系II(PSII)が優先的に損傷を受ける。光合成生物は,損傷したPSIIを迅速に解体・修復することで,光合成活性を維持することができるが,損傷の速度が修復の速度を上回ると光合成活性の低下を引き起こす。これは,光合成の光阻害と呼ばれる現象。
これまでのPSII修復に関する研究では,タンパク質にのみ着目した研究がほとんどで,PSIIに含まれる脂質については見過ごされてきた。また,PSII修復の際に起こる解体メカニズムに関しては不明だった。
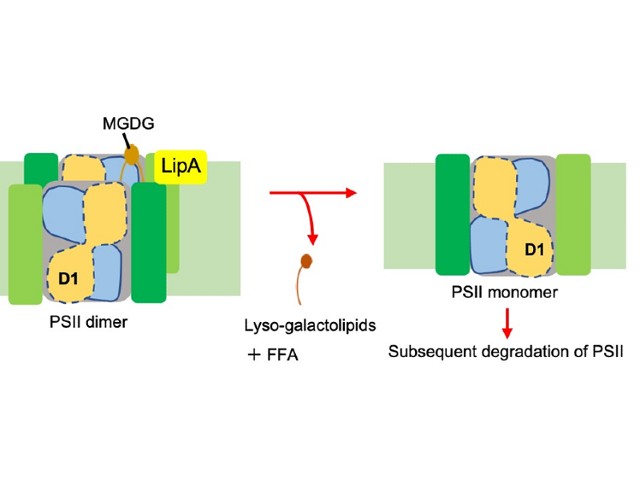
そこで研究グループは,PSIIに含まれる脂質分子に着目し,脂質を分解するリパーゼ酵素のPSII修復における役割について研究を進めた。研究では,シアノバクテリアの一種であるSynechocystis sp. PCC 6803を用いた。このシアノバクテリアには3つのリパーゼタンパク質が存在し,そのうち最もシアノバクテリア種間で保存されているSll1969タンパク質について生化学的に解析した。
その結果,このリパーゼはPSIIの二量体に特異的に結合しており,葉緑体やシアノバクテリアのチラコイド膜を構成する4種類の膜脂質のうち,ガラクトースが付加されたモノガラクトシルジアシルグリセロール(MGDG)及びジガラクトシルジアシルグリセロール(DGDG)を特異的に分解することを明らかにした。
さらに,貯蔵脂質であるトリアシルグリセロール(TAG)も分解することが明らかになった。また,Sll1969遺伝子を欠損した変異株を作製し,PSII修復への影響を解析したところ,PSIIの二量体が単量体となる速度が遅く,損傷したタンパク質の分解が遅くなっていることが明らかとなった。
これらの結果は,PSIIの内部に存在するMGDGなどの脂質分子の分解が鍵となって,PSIIの解体・修復が行なわれることを示唆しており,これまでタンパク質を中心に考えられてきた修復メカニズムに一石を投じる研究成果だとする。
研究グループは今後,PSIIの修復機構を,タンパク質だけではなく脂質の観点からも解き明かしていく予定。この成果は今後,光合成生物を用いた物質生産研究において,脂質の重要な役割を考慮するための知見となるとしている。