関西医科大学と米国国立衛生研究所(NIH)は,光免疫療法の新規標的分子として,主要な細胞接着分子の1つであるICAM1が,この治療の非常に有望な標的分子であることを,2つのトリプルネガティブ乳がんの腫瘍モデルにおいて確認した(ニュースリリース)。
関西医科大学と米国国立衛生研究所(NIH)は,光免疫療法の新規標的分子として,主要な細胞接着分子の1つであるICAM1が,この治療の非常に有望な標的分子であることを,2つのトリプルネガティブ乳がんの腫瘍モデルにおいて確認した(ニュースリリース)。
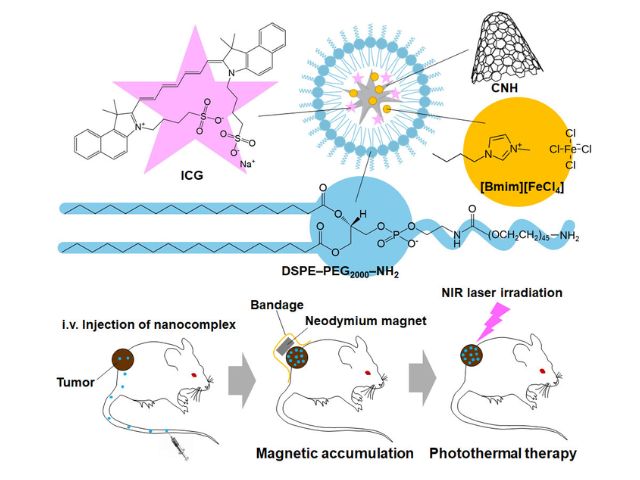
光免疫療法は,がん細胞に多く吸着する薬剤を投与し,人体にほとんど影響を与えない近赤外光を照射すれば,がん細胞に取り付いた薬剤が化学変化を起こして物理的にがん細胞を破壊する,という仕組みでがんを治療する。
日本においては,「切除不能な局所進行又は局所再発の頭頸部癌」に対する治療として2020年9月に承認され,現在は保険診療として治療を受けることできる。
光免疫療法用の薬は,がん細胞の表面に多く出ている目印(抗原)にくっつくタンパク質(抗体)に,光に反応する物質をつけたもの。この薬を点滴投与すると徐々にがんに集まっていき,1日くらいでがん細胞に多くの薬がくっつく。そこにレーザー光を当てると薬が反応し,薬がたくさんくっついたがん細胞は破裂して死滅する。
一方で正常細胞は,光免疫療法用の薬がほとんどくっつかないため,レーザー光を当ててもダメージを受けない。また光免疫療法用の薬自体は細胞にダメージを与えず,使用するレーザー光も人体に害を及ぼさないので,抗がん剤のような治療部位以外での副作用はなく,患者にやさしいがん治療法といえる。
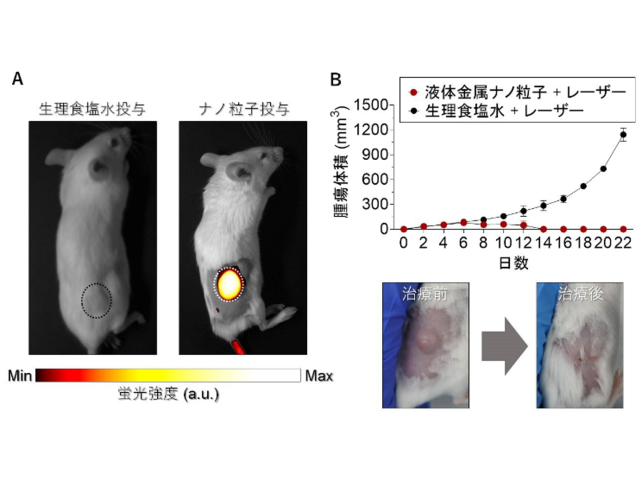
今回の研究では,MDAMB468-lucとMDAMBm231というトリプルネガティブ乳がん(TNBC)の2つの細胞株をマウスの皮下に移植し,光免疫療法の新規標的分子としての有用性を調べた。
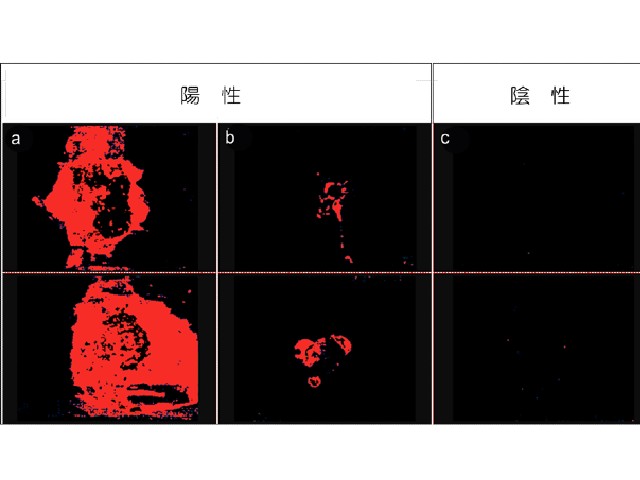
試験管内で,トリプルネガティブ乳がん由来の細胞に近赤外線光を照射したところ,容量依存的に細胞に損傷が起きることを確認。また,生体内でICAM-1をターゲットに近赤外線光を照射したところ,細胞質の空胞形成などが起き,がん細胞に損傷が与えられていることが確認できた。
形態的には損傷がないように見えたがん細胞も,治療後2時間以内にアクチン細胞骨格の異常な分布と,Ki-67陽性の著明な減少が認められた。これはつまり,ICAM-1をターゲットとした近赤外線光照射により,がん細胞がダメージを受け増殖が抑制されたことを意味する。
今回確認された近赤外線光の照射によるがん細胞の病理学的な損傷は,腫瘍の拡大を抑制し,腫瘍移植マウスの生存を改善した。研究グループは,ICAM-1を標的とした光免疫療法が,将来トリプルネガティブ乳がんに臨床応用できる可能性を示唆す成果だとしている。