 東京大学の研究グループは,鼻の粘膜のうち嗅粘膜のみを特異的に描出し,その障害を客観的に評価するための分子を同定した(ニュースリリース)。
東京大学の研究グループは,鼻の粘膜のうち嗅粘膜のみを特異的に描出し,その障害を客観的に評価するための分子を同定した(ニュースリリース)。
嗅覚受容機構はマウスをモデル生物として用いて分子レベルで解明されてきている。しかしヒトの嗅覚障害に目を向けると,その分子レベルでの病態は不明のままだった。
このヒトの嗅覚障害の病態生理が不明である理由として,嗅覚機能および嗅覚器の状態を正確に把握できる方法が無いことが挙げられる。臨床におけるヒトの嗅覚機能検査は,被験者の主観的な匂いの認知感覚に依存した主観的な検査方法のみであり,他覚的な評価方法はない。そのため現在の嗅覚障害の診断分類は,嗅覚障害を引き起こした原疾患とその障害部位の推測によるものとなっている。
またヒトの嗅覚障害患者の嗅粘膜の組織解析では,嗅上皮が無神経化や呼吸上皮化生を起こすと報告されているが,実際の臨床において嗅粘膜の組織生検を行なうことはできない。そこで生検せずに内視鏡で観察することで嗅粘膜の状態を評価することができれば,嗅覚障害の診断および治療評価等に有用となる。
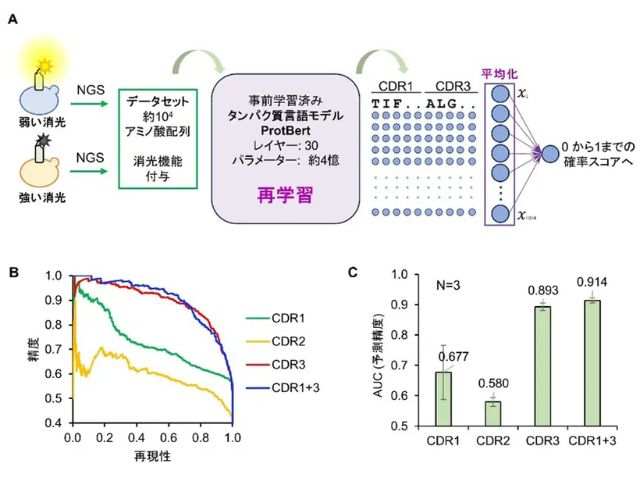
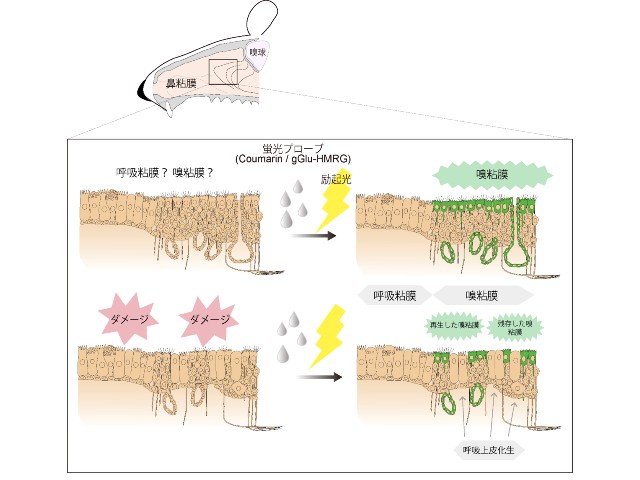
この研究ではヒトの鼻腔粘膜の全ゲノム解析のデータから,呼吸粘膜と比較して嗅粘膜に優位に発現しているcytochrome p450-2A6(CYP2A6)およびγ-glutamyltranspeptidase(GGT)という2つの酵素を抽出し,その基質であるCoumarinおよびgGlu-HMRGという2つの分子に着目した。
まずCYP2A6およびGGTの2つの分子がヒトおよびマウス嗅粘膜の支持細胞および腺組織に特異的に発現していることを示した。そしてこれらの酵素の基質であるCoumarinおよびgGlu-HMRGが,嗅粘膜のこれらの細胞で代謝され,その代謝産物が蛍光を発する性質を利用することで,嗅粘膜を描出できることを確認した。
これらをプローブとしてマウスの鼻粘膜に噴霧をして励起すると,迅速に嗅粘膜のみが発光するため,嗅粘膜を特異的に描出できる。さらにマウスの嗅粘膜障害モデルでの検討では,これらのプローブは無神経化した嗅上皮は描出しないが,再生した嗅粘膜は描出することがわかり,嗅粘膜の状態を直接観察して把握できることを明らかにした。
これらのプローブが将来的にヒトでの応用が可能となった場合,内視鏡下の観察により嗅粘膜の状態を観察できるようになり,嗅覚診療の大きな変換点となる可能性があるという。
研究グループは,さらに嗅粘膜を直接可視化できるようになることで,内視鏡下鼻副鼻腔手術や頭蓋底手術等にも貢献できるとしている。