 北海道大学の研究グループは,光増感分子(Photosensitizer:PS)を搭載したミトコンドリア標的型ナノカプセルの構築に成功し,ヒト由来の癌を担持するマウスを用いた検証実験を行ない,「ミトコンドリアを狙い撃ちする癌光治療戦略」の有用性を示すことに成功した(ニュースリリース)。
北海道大学の研究グループは,光増感分子(Photosensitizer:PS)を搭載したミトコンドリア標的型ナノカプセルの構築に成功し,ヒト由来の癌を担持するマウスを用いた検証実験を行ない,「ミトコンドリアを狙い撃ちする癌光治療戦略」の有用性を示すことに成功した(ニュースリリース)。
癌光治療は,患部切除を行わずに選択部位の癌組織を死滅させるため,患者の身体的負担が少ない治療法として期待されている。一方で,現状の光治療法では,殺しきれなかった癌細胞が増殖することによる耐性癌発生リスクがあり,それを解決する治療法の開発が望まれている。
そこで研究グループは,癌細胞のエネルギー工場であるミトコンドリアを破壊する新たな癌光治療の検証を試みた。
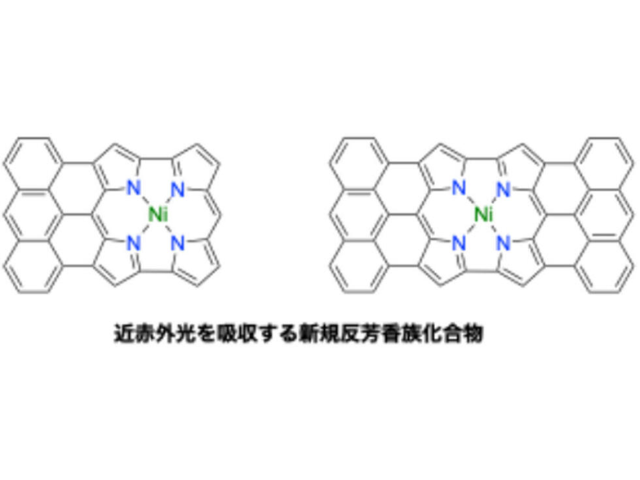
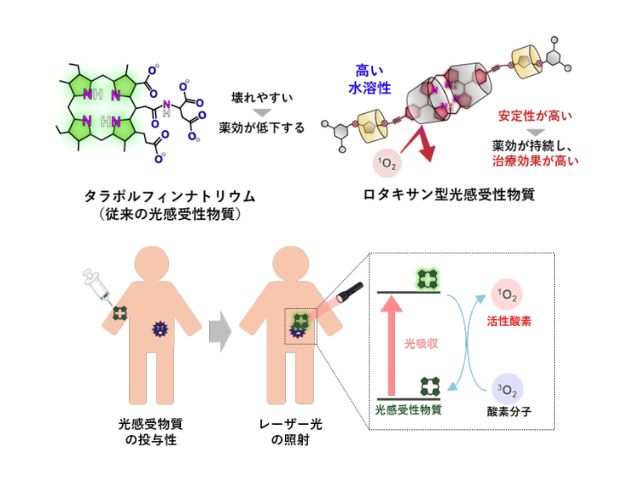
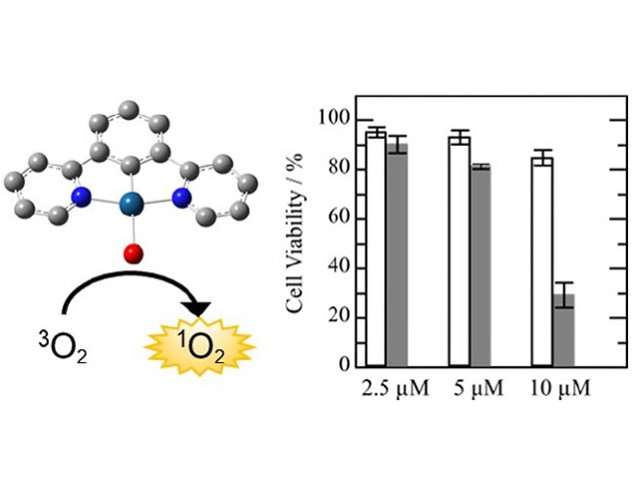
光照射によってミトコンドリア内で活性酸素発生を誘導するPSとして近赤外(700nm)の光照射によってミトコンドリア内で活性酸素発生反応を誘導し得るポルフィリン骨格を有する独自の新規化合物(rTPA)を選択した。
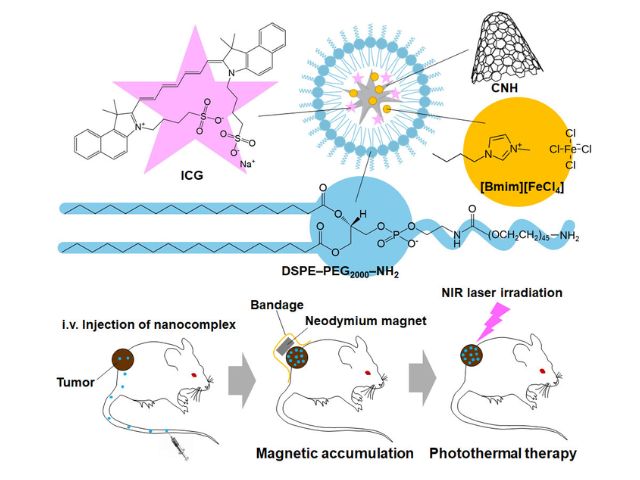
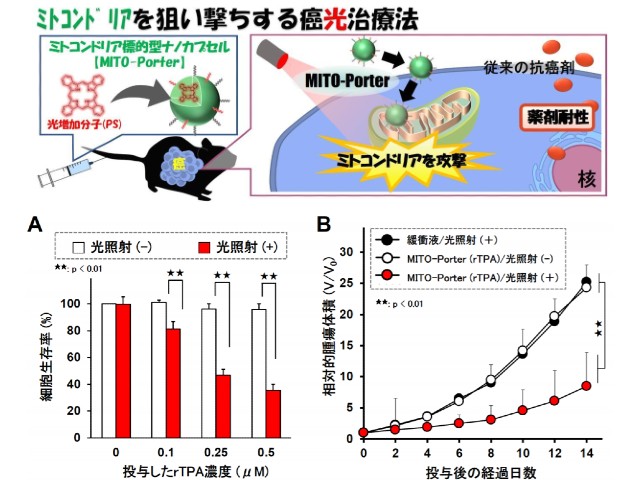
また,分子送達に関しては,研究グループが開発したミトコンドリア標的型ナノカプセル,MITO-Porterを用いた。ミトコンドリアにrTPAを運ぶために,rTPAを搭載した MITO-Porter(MITO-Porter(rTPA))の構築を検討し,ナノサイズの粒子を調製することに成功した。
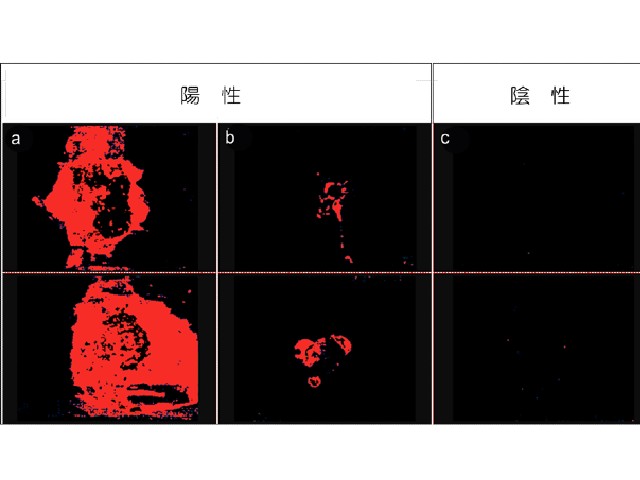
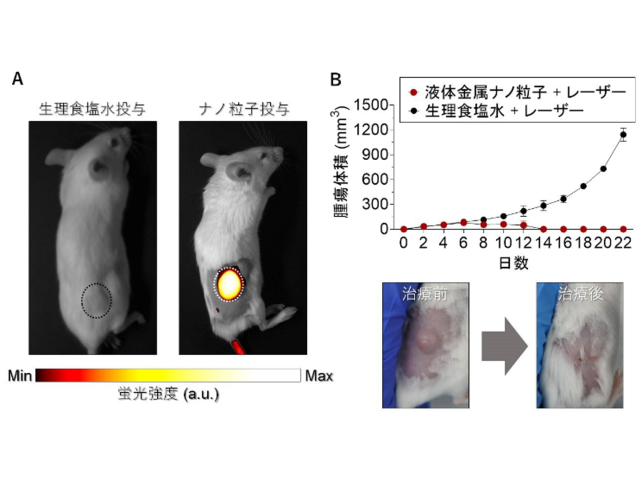
モデル癌細胞として使用したヒト舌癌細胞(SAS cell)を皮下移植した担癌モデルマウスを作成・評価した結果,MITO-Porter(rTPA)投与・光照射群において,癌の増殖を著しく抑制する治療効果を観察したとする。
研究で採用する「ミトコンドリアを狙い撃ちする癌治療戦略」は既存薬の抗癌作用機序と異なり,薬剤耐性癌の治療にも有用であると期待されるという。また,癌細胞にピンポイントに抗癌剤を運ぶナノカプセルは正常細胞への侵襲性を抑えることが期待されるため,「効果がでているのに副作用で治療を断念」などの問題点の解決にもつながる可能性がある。
研究グループは,さらに多彩な機能を有するミトコンドリアを標的とした,創薬開発の医療用ナノカプセルの基盤技術としても貢献できるとしている。