 慶應義塾大学,米ジョージア工科大学,米シンシナティ小児病院は,網膜神経節細胞に発現する非視覚型光受容体OPN5(ニューロプシン)が短波長可視光領域の光を受容することにより近視進行を抑制することを解明した(ニュースリリース)。
慶應義塾大学,米ジョージア工科大学,米シンシナティ小児病院は,網膜神経節細胞に発現する非視覚型光受容体OPN5(ニューロプシン)が短波長可視光領域の光を受容することにより近視進行を抑制することを解明した(ニュースリリース)。
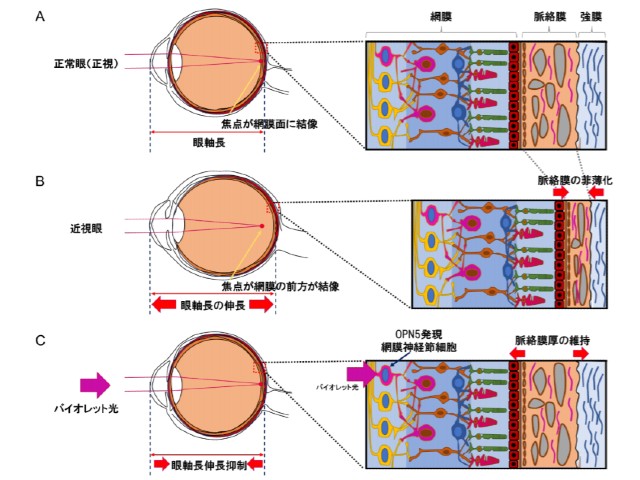
研究グループは,360nm~400nmの可視光(バイオレット光)が近視進行を抑制することを世界で初めて報告した。一方,その作用機序については詳細に解明されていなかった。
今回,研究グループは独自に開発した近視モデルマウスを用いて,バイオレット光がマウス網膜内層の網膜神経節細胞に発現する光受容体OPN5(ニューロプシン)で受光されることにより,脈絡膜厚を維持することで近視進行を抑制する仕組みを解明した。
OPN5は近年新たに発見された光受容体で,ヒト,マウスにおいてバイオレット光領域内の380nmを最大吸収波長に持つ。網膜視細胞に発現する光受容体とは異なり,OPN5は視覚に寄与せず,網膜局所の概日リズムや眼内の血管発生,深部体温の調節などに関与していることがこれまで報告されているが,その機能全容はいまだ不明となっている。
近視モデルマウスに一日3時間のバイオレット光を照射すると,これまでヒヨコ近視モデルあるいは臨床でみられた眼軸長伸長抑制効果をマウスでも同様に観察した。一方,網膜神経細胞特異的にOPN5を欠損させたノックアウトマウスでは,バイオレット光による眼軸長伸長抑制効果(近視進行抑制効果)が失われることがわかった。これは,網膜内層に存在する網膜神経節細胞が発現するOPN5が,バイオレット光を眼内で受光することで,近視進行抑制効果をもたらすことを示唆している。
さらに,研究グループは脈絡膜厚の変化に注目。近視誘導に伴い菲薄化する脈絡膜厚をバイオレット光で維持することができる一方,OPN5ノックアウトマウスではその維持効果が消失することがわかった。これらの結果は,OPN5によるバイオレット光刺激が脈絡膜厚を制御することを示しており,脈絡膜厚の変化が眼軸長伸長(近視進行)に影響を与えることを示唆している。
研究グループは,この知見がバイオレット光の近視抑制効果を理論付けるだけでなく,近年新たに発見された非視覚型光受容タンパク質OPN5の機能解明にも繋がり,今後近視進行抑制の標的として有用な介入方法の開発の一助になることが期待されるとしている。