大阪大学と理化学研究所は,表面増強ラマン散乱(SERS)を用いることで,小さなアルキンタグをつけた低分子薬剤(小分子)が生きた細胞内へ取り込まれる様子をリアルタイムで観察することに世界で初めて成功した(ニュースリリース)。
大阪大学と理化学研究所は,表面増強ラマン散乱(SERS)を用いることで,小さなアルキンタグをつけた低分子薬剤(小分子)が生きた細胞内へ取り込まれる様子をリアルタイムで観察することに世界で初めて成功した(ニュースリリース)。
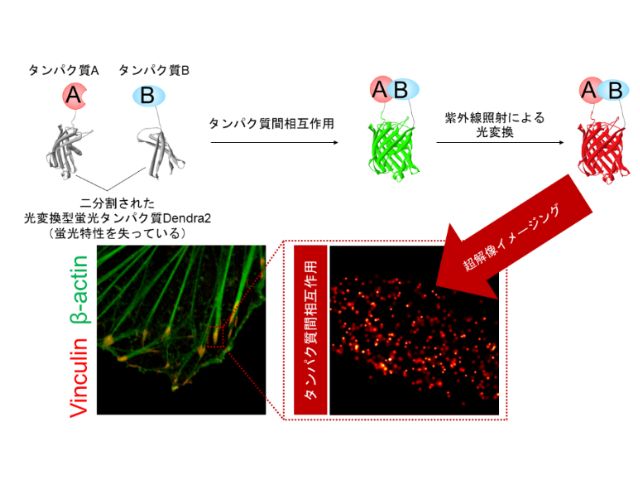
ラマン散乱顕微鏡は,分子の化学結合を直接検出することで,分子の空間分布を観察できる。さらに,生体分子に含まれないアルキン(炭素間三重結合をもつ構造)を観察対象の小分子のタグ(標識)として付加することで,細胞内の複雑な環境下においても対象分子を選択的に観察できる。
しかし,ラマン散乱は非常に微弱であるため,観察時間が数十分程度かかることから,細胞内への小分子の取り込みをリアルタイムに観察することはできなかった。
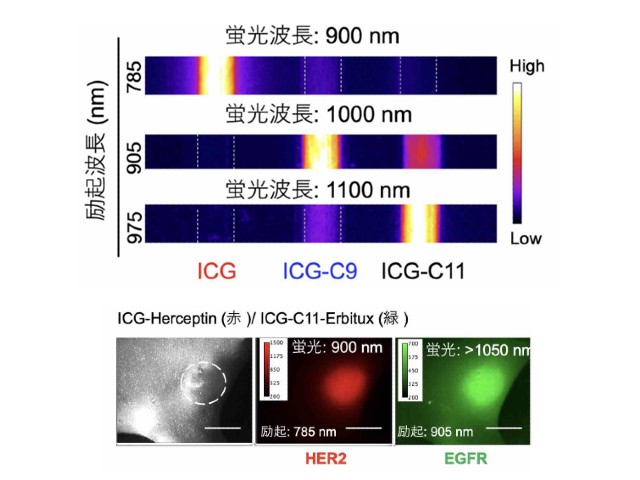
SERSは粒子にレーザーを照射することで,粒子表面の分子のラマン散乱を増強することができ,粒子周り数nm領域の局所的な化学状態を高感度に計測できる。細胞のエンドサイトーシスを利用して金ナノ粒子を細胞内に導入することで,金ナノ粒子が表面近くの分子のラマン散乱を伝えるSERSプローブとして機能する。
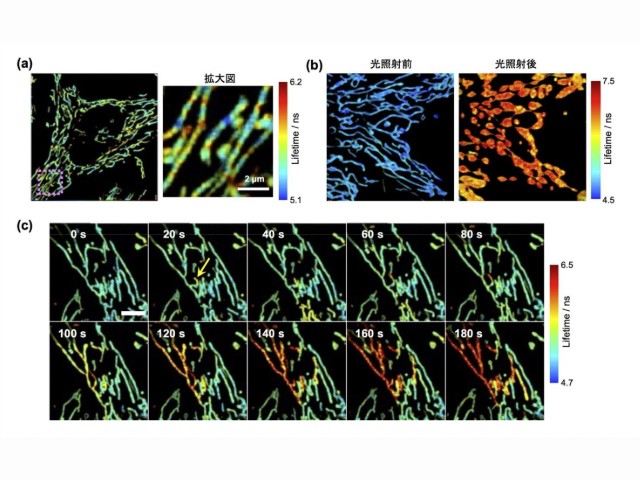
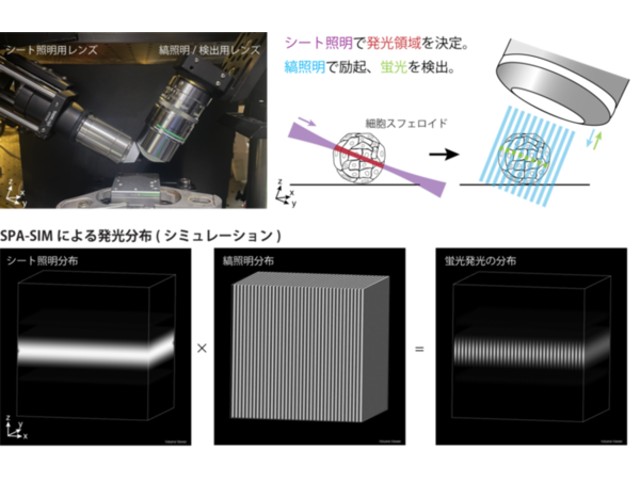
実験では,粒子を取り込んだ状態の細胞に小分子を投与し,独自に開発した高速ラマン散乱顕微鏡で計測した。細胞に取り込まれた小分子が粒子表面に到達するとアルキンの分子構造に由来する非常に強いSERSが発生し,細胞内における小分子の分布を高感度に検出することができた。さらに,3次元空間の経時観察中に小分子を投与することで,小分子が生きた細胞内に取り込まれる様子を捉えることに成功した。
薬剤取り込み速度の定量評価のため,単一細胞レベルでアルキンのSERS信号数を計数する新しい解析法も開発した。この手法に基づいて,異なる小分子投与濃度において細胞の取り込み速度が変化することを定量的に示した。
この研究成果により,金ナノ粒子によるSERSを用いることで,アルキンのラマン散乱を数桁以上増強させ,細胞内に取り込まれた小分子を高感度に検出することが可能となった。3次元観察と経時観察を組み合わせた計測によって小分子が細胞内に取り込まれる様子を観察することに成功し,投与濃度などの異なる化学的・物理的環境下によって取り込み速度が変化することを定量的に示した。
研究グループは,ラマン顕微観察において金ナノ粒子とアルキンを用いたこの技術は,様々な種類の細胞や薬剤分子への応用が可能であり,細胞内への取り込みの時間的ダイナミクスを調査するための新たな技術になることが期待されるとしている。