 京都大学は,哺乳類細胞において,「青色光」により遺伝子のスイッチ(遺伝子発現)を効率良くオン/オフできる新しいGal4/UAS誘導系システムを開発した(ニューリリース)。
京都大学は,哺乳類細胞において,「青色光」により遺伝子のスイッチ(遺伝子発現)を効率良くオン/オフできる新しいGal4/UAS誘導系システムを開発した(ニューリリース)。
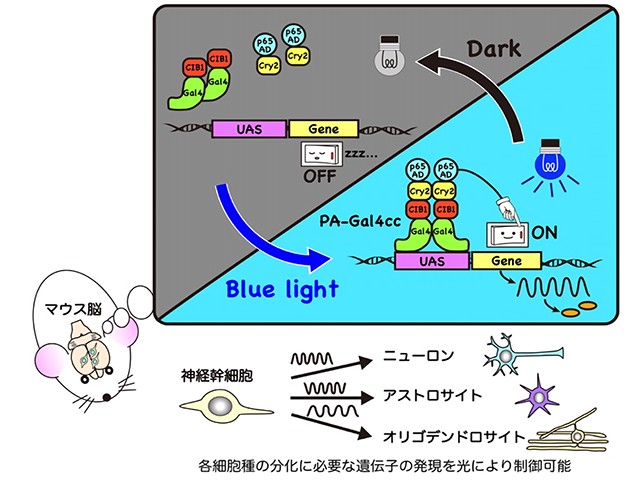
これまで酵母細胞などを用いて,光を利用した遺伝子発現制御技術が改良されてきたが,哺乳類細胞では機能しない場合が多く存在した。そこで研究グループは,シロイヌナズナ由来の光受容体に着目し,それを従来の遺伝子発現制御技術であるGal4/UASシステムと組み合わせることによって,遺伝子発現のオン/オフを「青色光」で制御できる新しい技術の開発に成功した。
この技術(PA-Gal4cc光作動性転写因子)は,従来,光照射によって遺伝子発現のオン/オフを制御するシステムとして用いられてきたGAVPOと比較して,暗所における遺伝子発現誘導が起きにくく,かつ,光に応答して誘導される遺伝子発現レベルが大幅に増加しただけではなく,すでに報告されていた類似のシステムと比較して,光依存性の遺伝子発現レベルが増加した。
実際,この技術を用いることにより,マウス脳の神経幹細胞などにおいて,遺伝子発現を光により効率良く制御できることが示された。
研究グループは,この技術によって,脳の発生や神経再生の過程で転写因子が示す複雑な遺伝子発現パターンを人工的に操作することができ,その機能的意義を検証できると考えているという。
将来的にはモデル動物の脳内の神経幹細胞にPA-Gal4ccを適応して,発生・幹細胞研究や神経科学研究への貢献を期待するほか,レンチウイルスベクターを用いて,PA-Gal4ccを哺乳類細胞に導入可能であることが分かったことから,遺伝子治療に用いられているウイルスベクターと組み合わせることで,幹細胞や臓器を対象とした次世代の再生医療の新規戦略開発へ発展することも期待されるとしている。