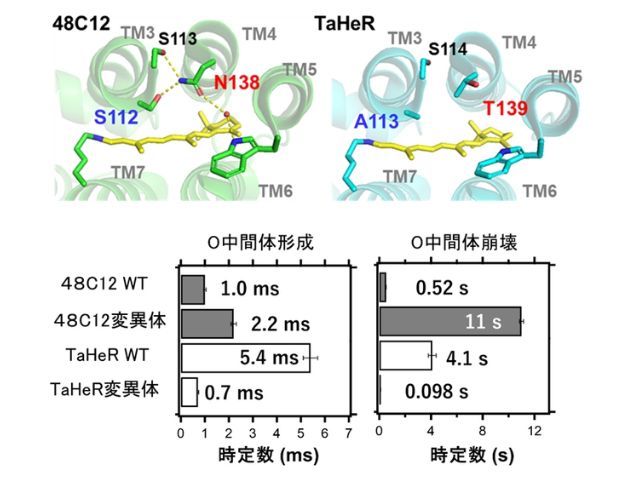
 沖縄科学技術大学院大学(OIST),ISTオーストリア,名古屋大学の研究グループは,吸入麻酔薬の作用メカニズムを調べ,シナプス前末端における伝達物質放出量の減少が,個体の意識レベルの低下をもたらすことが明らかにした(ニュースリリース)。
沖縄科学技術大学院大学(OIST),ISTオーストリア,名古屋大学の研究グループは,吸入麻酔薬の作用メカニズムを調べ,シナプス前末端における伝達物質放出量の減少が,個体の意識レベルの低下をもたらすことが明らかにした(ニュースリリース)。
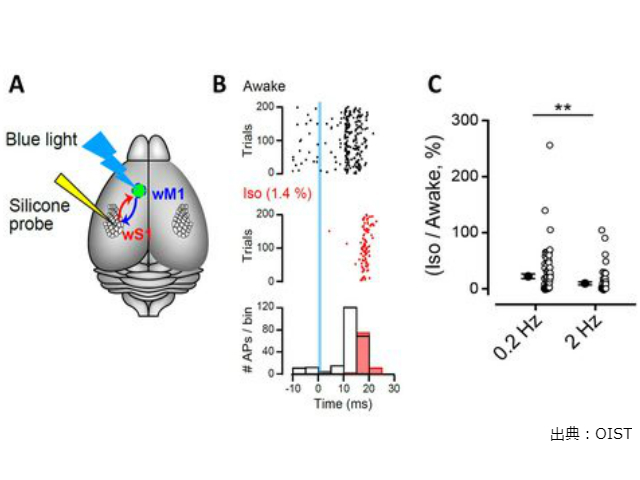
研究グループは,無麻酔マウスの頭部を固定して,大脳皮質の複数のニューロンから自発性活動電位の発火を記録し,光感受性イオンチャネルを発現させたシナプス前ニューロンを青色光で刺激して,活動電位(AP)を誘発した。麻酔薬イソフルランを吸入させると自発性,誘発性AP発火頻度が共に低下した。
麻酔薬吸入前後で刺激で誘発される発火を計測したところ,麻酔薬が高周波の活動電位発火を選択的にブロックすることを示唆した。
吸入麻酔薬の作用メカニズムを更に明らかにするため,ラット脳幹スライスのカリックス・シナプス前末端と後シナプス細胞から高頻度に誘発した活動電位を同時記録してイソフルランを灌流液に投与すると,後シナプス細胞の活動電位発火の脱落が観察された。
マウスで実験した結果と同様に,この抑制作用の強さは刺激頻度に依存していた。スライスのシナプスでも吸入麻酔薬は高周波の活動電位発火を選択的にカットすることが分かる。
この実験結果から,麻酔薬はシナプス前末端に作用して神経伝達をブロックすることが分かり,麻酔薬の標的は,カルシウムチャネル,開口放出タンパク質,小胞再利用機構のいずれかと推測された。そこで,それぞれの標的に対する麻酔薬の作用をテストした結果,イソフルランにはカルシウムチャネルをブロックする作用と,開口放出を直接ブロックする作用があるものの,小胞再利用には影響を与えないことが分かった。
シナプス前末端活動電位の発火頻度が低い時には,麻酔薬は専らカルシウムチャネルをブロックして伝達物質の放出量を減少させるが,高頻度発火によってカルシウムが大量に細胞外から流入すると,麻酔薬は開口放出機構にも作用して,伝達物質の放出を更に減少させる。小胞開口放出機構とカルシウムチャネルが共にブロックされることによって高周波電気信号が選択的に抑制されると結論した。
今回の研究は,シナプス前末端における伝達物質放出量の減少と個体の意識低下を関連付ける重要な研究成果としている。