 理化学研究所(理研),東京大学,日本医療研究開発機構(AMED)の研究グループは,筋収縮の機能単位であるサルコメア構造の一部となる分子ナノシステムを設計し,収縮中のモーター分子の動態を世界最高の解像度で直視することに成功した(ニュースリリース)。
理化学研究所(理研),東京大学,日本医療研究開発機構(AMED)の研究グループは,筋収縮の機能単位であるサルコメア構造の一部となる分子ナノシステムを設計し,収縮中のモーター分子の動態を世界最高の解像度で直視することに成功した(ニュースリリース)。
筋収縮の分子機構に関する研究は70年以上の歴史があるが,収縮の瞬間におけるモーター分子の動態を直接的に捉えることはできていなかった。
そこで研究グループは,DNAオリガミ技術とヒト筋肉のモータータンパク質(ミオシンII)を用いて,サルコメアの一部(分子ナノシステム)を人工的に設計し,高速原子間力顕微鏡(高速AFM)による画像化とレーザー暗視野顕微鏡による超高速観察を行なった。
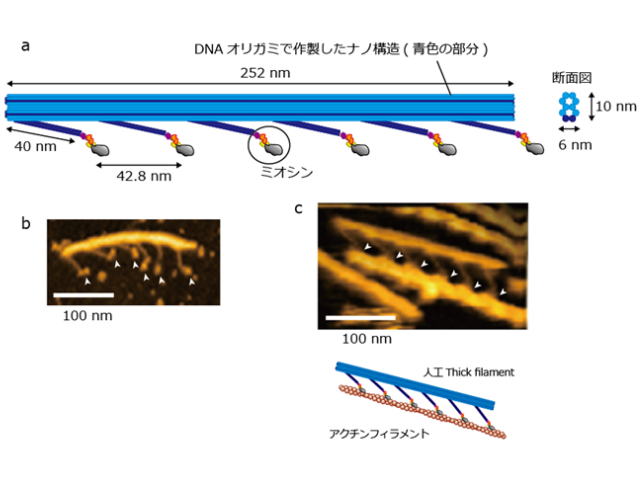
まず研究グループは,DNAオリガミ技術で作成した足場とヒト筋肉のミオシンを用いて,モータータンパク質のミオシン分子を天然の状態と同じように厳密に配置しつつ,その密度を調整できるナノシステム(人工thick filament)を設計した。
これにより,人工thick filamentに沿ってアクチンフィラメントが滑るときの筋肉ミオシンの分子形状を,高解像度で画像化することに世界で初めて成功した。ミオシンの「レバーアーム」と呼ばれる部位が収縮時に2段階で構造変化を起こし力が発生することで,十分な収縮が引き起こされる。
しかし,レバーアームがthick filament内の別のミオシンの影響を受け,1段階目の構造変化によって力が発生し停止したまま運動を終了したり(収縮),1段階目の力が発生した後に逆方向に構造変化し,力が発生する前の構造に戻り(弛緩),再度,構造変化を起こして力が発生したりする(収縮)など,柔軟なダイナミクスを持ちながら収縮を引き起こしていることが分かった。
次に,人工thick filamentの一部に,アクチンと安定な結合を保持するタンパク質を導入することで,ミオシンがアクチンから外れにくい状態を作れるよう設計した。そして,レーザー暗視野顕微鏡と高速撮影カメラを用いて,収縮の瞬間におけるミオシン分子の動きを世界最高の時間分解能で直接的に捉えることに成功した。
マイクロ秒の時間分解能で動きを捉えると,ミオシン分子がアクチンフィラメントに沿ってランダムに動きながら,収縮に必要な構造変化を起こすための最適な場所を探索しているのが分かった。また,ランダムな動きから方向性を持って最終的な着地点を選んでおり,「ブラウニアンラチェットと呼ばれる機構」が働いていることも分かった。
この研究成果は,直接的にモーター分子の機能を制御する低分子化合物の効果を精密に分析することを可能にし,新たな心不全治療薬の開発に貢献すると期待できるとしている。