 分子科学研究所,千葉大学,東京大学の共同研究グループは,高速高精度な1分子解析を用い,回転分子モーターV1の化学力学エネルギー変換機構を解明することに成功した(ニュースリリース)。
分子科学研究所,千葉大学,東京大学の共同研究グループは,高速高精度な1分子解析を用い,回転分子モーターV1の化学力学エネルギー変換機構を解明することに成功した(ニュースリリース)。
液胞型ATP加水分解酵素(V-ATPase)はナノサイズの回転分子モーターであり,力学的な回転運動により,ATP(アデノシン三リン酸)の化学エネルギーをイオンの電気化学ポテンシャルに変換する。V-ATPaseと類似した構造を持つ,生体内でATPを合成するF型ATP合成酵素(F-ATPase)も回転分子モーターであり,ATPを合成する。
この回転分子モーターによる化学エネルギーと力学エネルギーの変換の仕組み(化学力学共役機構)を解明するため,回転運動を直接観察する1分子解析,および原子レベルで立体構造を明らかにするX線結晶構造解析が行なわれてきた。
これまでは特に、F1モーターで研究が進んでおり,その化学力学共役機構はほぼ解明されている。他方,V1モーターについては,X線結晶構造解析により構造の情報は得られていたものの,詳細な1分子解析は行なわれておらず,化学力学共役機構の詳細は明らかになっていなかった。
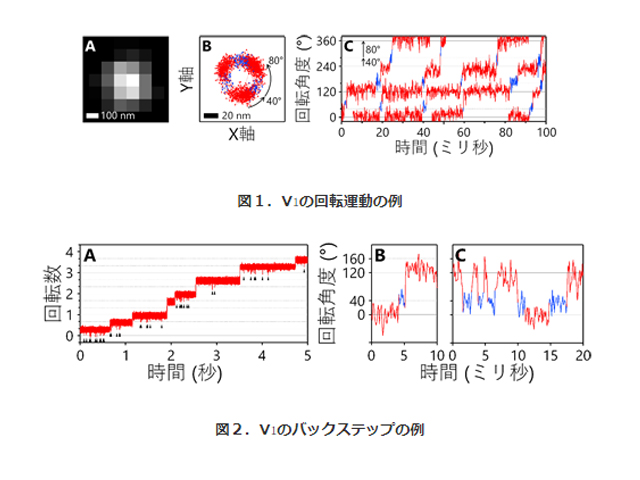
研究グループは,高分解能の構造情報が得られている腸球菌由来のV1を対象とし,V1モーターの回転軸に直径40nmの金ナノ粒子を回転運動の可視化プローブとして取り付け,独自に開発した対物レンズ型全反射照明暗視野レーザー顕微鏡を用いて100μsの時間分解能で回転運動を1分子解析することに成功した。
その結果,類縁の回転分子モーターF1とは機構が大きく異なり,この機構の違いはそれぞれが生体内で果たす役割の違いと密接に関係していることが示唆されたという。
研究グループはこの研究を,V-ATPase全体のエネルギー変換機構の研究へとさらに発展させることで将来,生体に適合したナノサイズの発電装置の開発等に繋がる可能性が期待されるとしている。