東京大学と名古屋工業大学らの研究グループは,X線結晶構造解析を用いてヘリオロドプシンの立体構造を決定した(ニュースリリース)。
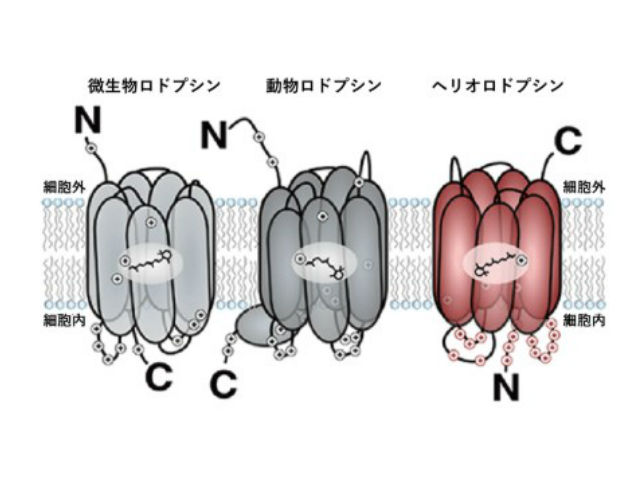
目の中で視覚を担う膜タンパク質の1つである光応答性タンパク質のロドプシンは,細菌からヒトに至るまで多くの生物が持ち,多くは光によってイオンを細胞内外に輸送する。微生物ロドプシンを動物の脳神経細胞に発現させ,神経興奮や抑制を光で制御することによって動物の行動を操作するオプトジェネティクス(光遺伝学)への応用からも注目されている。
2018年に発見されたヘリオロドプシンはこうした既存のロドプシンとはアミノ酸配列が大きく異なり,イオンを輸送する性質がない。さらに光反応サイクルが遅いことから,未知の情報変換分子を介した光情報伝達に関わるものと推測されているが,その構造もわかっていなかった。
さらにヘリオロドプシンを持つ生物種の多くはレチナール生合成系をもっておらず,環境中に存在するレチナールを取り込んで機能すると推測されたが,その機構も不明だった。
今回研究グループが,好酸菌由来のヘリオロドプシンのX線結晶構造解析を行なった結果,ヘリオロドプシンの膜貫通領域の構造はバクテリオロドプシンと似ており,配列相同性が低いにもかかわらず両者が共通した構造であることが明らかになった。さらに,バクテリオロドプシンとよく似た形でレチナールがリジンに共有結合していたことがわかった。
一方,細胞外ループは伸びたシート構造をとり,結晶構造中では隣の分子の上を覆うことで密な二量体を結晶構造中で形成していた。さらにこの二量体が脂質二重膜中の生理的な条件でも保たれていることを確認し,ヘリオロドプシンは基本的に二量体として機能することを明らかにした。
また,細胞に発現させたヘリオロドプシンで1細胞のイメージングを行ない,確かにヘリオロドプシンは通常のロドプシンと逆の膜トポロジーを持つことも明らかにした。
ヘリオロドプシンの細胞外側は疎水的なアミノ酸残基で塞がり,イオンや基質が通る隙間はなかった。こうしたアミノ酸残基はヘリオロドプシンの間で保存性が高く,全てのヘリオロドプシンは微生物ロドプシンのような輸送体としては機能できないと推測した。
一方,細胞内側はレチナールから細胞内ループにわたって,水分子を介した広範な親水性相互作用が存在しており,光受容に伴うヘリオロドプシンの構造変化に重要であると考えた。また時間分解赤外分光解析により,長寿命のO中間体における特徴的な構造変化が1秒間以上,持続することも明らかにした。
研究グループは,今回の研究成果はヘリオロドプシンの構造機能を明らかにするとともに,ロドプシンの多様性や新規ロドプシンの探索に役立つとしている。