 京都大学の研究グループは,二光子励起で効率よく活性化できる蛍光タンパク質からの蛍光共鳴エネルギー移動を利用して,植物が光を感じ取るための光応答性分子であるCRY2を二光子励起で活性化する技術を開発した(ニュースリリース)。
京都大学の研究グループは,二光子励起で効率よく活性化できる蛍光タンパク質からの蛍光共鳴エネルギー移動を利用して,植物が光を感じ取るための光応答性分子であるCRY2を二光子励起で活性化する技術を開発した(ニュースリリース)。
イメージングの技術やツールの進歩により,生体内のシグナル伝達を高い時空間解像度で観察することが可能になってきた。しかし,観察したシグナルと,結果として生じる表現型との因果関係を証明することは,観察のみでは難しい。
この問題の解決策として,植物が光感知に用いる光応答性分子を用い,シグナル伝達経路を光で操作する光遺伝学ツールが開発されてきた。一方,従来型の光遺伝学ツールは試験管内で飼育される培養細胞では使用されているが,生きたマウスの体の中での使用例はほとんどなく,更なる工夫が必要だった。
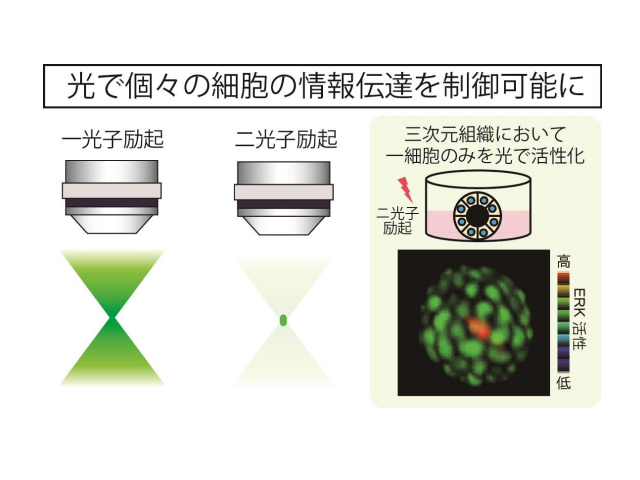
そこで研究グループは,マウス生体内で使用可能な光遺伝学ツールの開発を目的として研究を行なった。生体組織は光を通しにくいため,組織深部を見るためには組織透過性のよい光を用いた二光子顕微鏡を使用する。そこで,二光子励起法により,光遺伝学ツールの一つであるCRY2分子の活性化を試みた。
しかしながら,CRY2は二光子での活性化効率が非常に低く,このままの状態では生体内での使用に不向きであることが解った。そこで研究グループは,二光子励起効率の高い青色蛍光タンパク質(BFP:Blue Fluorescent Protein)からの,蛍光共鳴エネルギー移動により,CRY2を二光子励起で活性化する手法を考案した。
そして蛍光共鳴エネルギー移動効率の測定と,タンパク質構造予測の技術を用いて,効率的にエネルギー移動が起こる分子構造を模索し,二光子励起で活性可能なCRY2システムの開発に成功した。
この技術の有用性を示すため,細胞増殖やがん化に重要なERK分子を光で活性化する事ができるシステムを作製し,培養細胞由来の三次元の管腔構造体や生きたマウスの皮膚において,単一細胞レベルの非常に高い空間解像度でERK活性を制御できることを示した。更に,ERK分子の細胞間の伝播は,正常時の皮膚では抑制されており,増殖時には促進される事を発見した。
この成果により,生体内での細胞間情報伝達の研究が進み,生体組織における生理学的な機能や,病気のメカニズムの解明につながることが期待できるという。研究グループは今後,様々な分子を光で操作ツールを作製し,生体内の情報伝達の方法について調べて行きたいとしている。