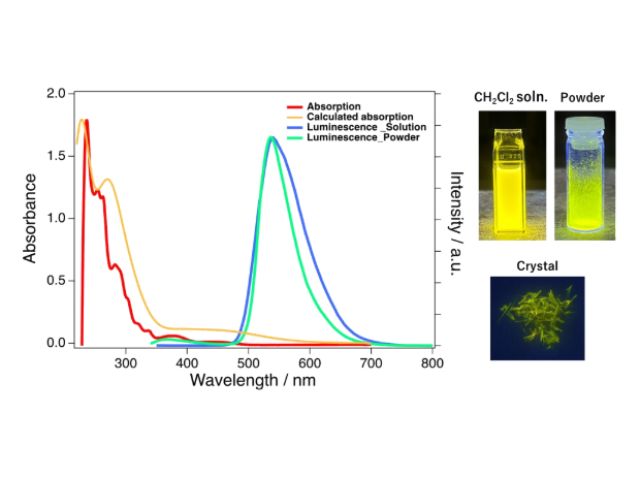
 東京農工大学,学習院大学,立教大学は,化学反応が極めて起こりにくい炭素-水素結合を連続的に変換することで,多環式化合物を立体選択的にかつ少ない反応段階で合成することに成功した(ニュースリリース)。
東京農工大学,学習院大学,立教大学は,化学反応が極めて起こりにくい炭素-水素結合を連続的に変換することで,多環式化合物を立体選択的にかつ少ない反応段階で合成することに成功した(ニュースリリース)。
環境問題が大きな社会問題となっている現在,より廃棄物の少ない化学合成法の開発が強く望まれている。この社会ニーズに対して,炭素-水素結合の直接変換法が注目されている。
この反応は有機化合物中の炭素-水素結合を一段階の反応で目的の分子に変換する手法であり,水素部分を反応性の高い官能基に替える予備段階が不要なため,合成に関わる工程数を少なくし,廃棄物を大幅に削減できる。
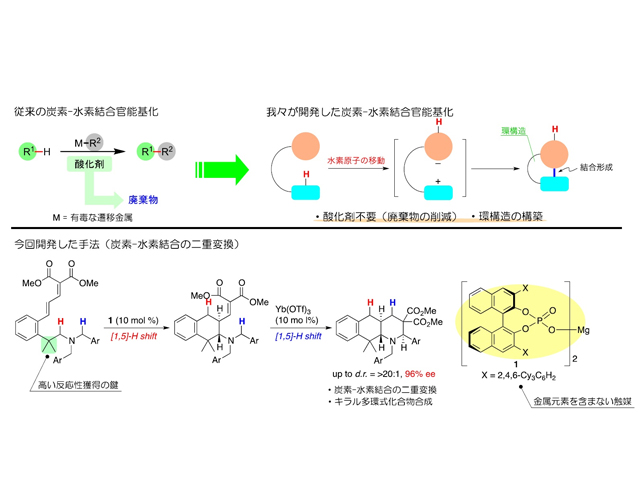
これまでにさまざまな直接変換法が開発されてきたが,高価で有毒な遷移金属触媒や反応後に廃棄物となる酸化剤が必要という課題があった。また,これまでのほとんどの方法は単一の炭素-水素結合の変換に関するものであり,医薬品候補等の複雑な化合物を少ない反応段階で合成できる炭素-水素結合の直接二重変換に成功した例は限られていた。
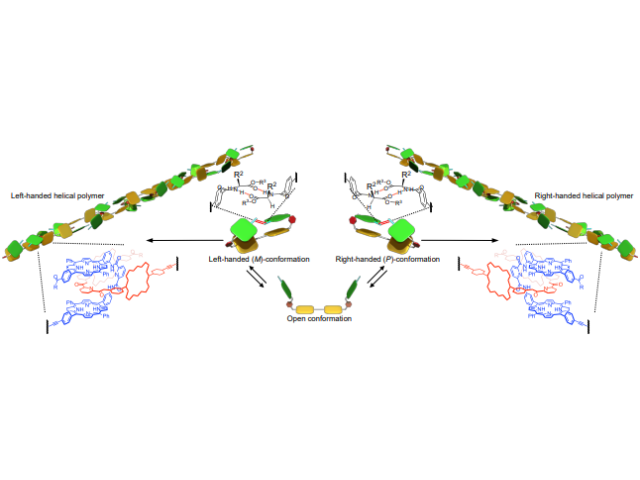
研究では,遷移金属触媒や外部酸化剤を必要としない炭素-水素結合変換法を連続的に用いた,多環式化合物の不斉合成法(鏡像となる2種類の化合物から,目的の立体構造のみ選択的に合成する方法)の開拓を目指し研究を行なった。
反応の達成にあたって重要なのは,困難な反応を進行させるための高い反応性の獲得だった。様々な検討の結果,二つのアルキル基を持つ出発原料を用いることで,窒素原子の隣接位にある炭素-水素結合の官能基化が連続的に進行することを見出し,従来法では合成困難な三環式窒素化合物を高い立体選択性で合成することができた。
またこの反応は,有毒な金属元素を含まない,環境に優しい触媒であるキラルリン酸により反応が達成できているという。
今回は窒素原子を含む化合物を用いた化合物に関するものだが,この研究成果を利用することで酸素原子を含む化合物,さらに炭素原子のみを含む化合物合成も可能。さまざまな新規医薬品候補化合物の効率的な供給につながることが期待できるとしている。