兵庫県立大学,理化学研究所,高輝度光科学研究センターは,X線自由電子レーザー施設SACLA(BL3)を利用して,哺乳動物のチトクロム酸化酵素(呼吸酵素)の反応に伴う構造変化を精密に決定し,この酵素が食物から生命活動のための(生きるための)エネルギーを無駄なく獲得する仕組みを解明した(ニュースリリース)。
兵庫県立大学,理化学研究所,高輝度光科学研究センターは,X線自由電子レーザー施設SACLA(BL3)を利用して,哺乳動物のチトクロム酸化酵素(呼吸酵素)の反応に伴う構造変化を精密に決定し,この酵素が食物から生命活動のための(生きるための)エネルギーを無駄なく獲得する仕組みを解明した(ニュースリリース)。
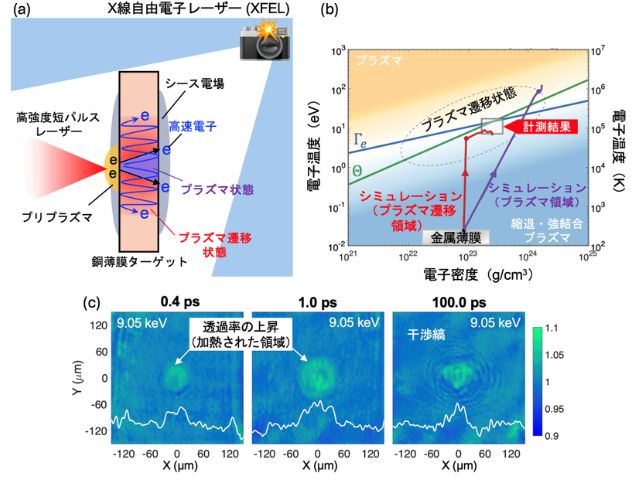
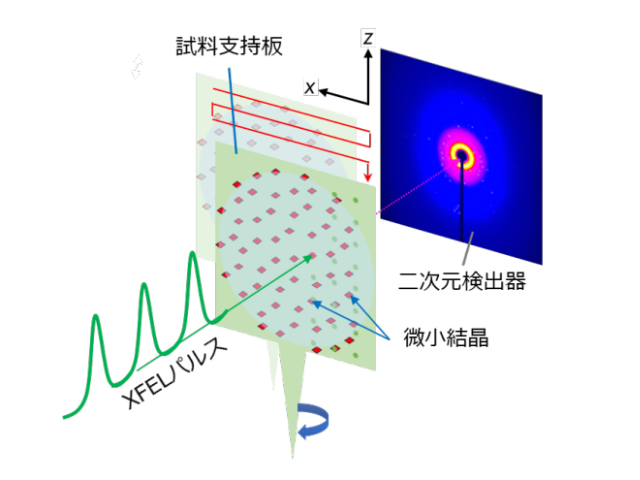
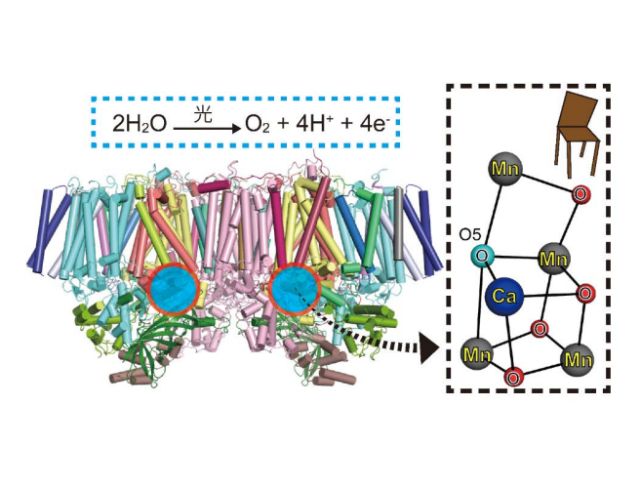
この研究ではSACLAによりO2とほとんど同じ様式でCcOと反応する一酸化炭素(以下COと略記)とCcOとの反応に伴うCcOの立体構造の時間変化を追跡し,水素イオンがH-経路に取り込まれた後に,O2が活性中心に含まれている銅イオンに結合することによりH-経路を閉鎖することを明らかにした。
このようにして,水素イオンの逆流が効率よく防止されるため,取り込みも促進される。このような発見はタンパク質の高速の立体構造変化を正確に追跡することのできるSACLAを利用することができてこそ可能になった。
CcOのエネルギー集積効率が精妙に制御されて,組織や細胞の正常な活動(恒常性)が維持されていることが,最近の種々のCcO活性制御因子(タンパク質)の発見により強く示唆されるようになっている。
したがって,この研究によるCcOのエネルギー集積(獲得)機構の解明は生命現象の理解を深めることに貢献するだけではなく,CcO活性制御因子による組織や細胞の活動の制御機構の解明,したがって疾病の機構の解明に大きく寄与する可能性がある。
また,H-経路の構造と機能は動物にしか保存されていないことが今回の研究によりさらに確実になったので,創薬のターゲットになる可能性もあるとしている。