 オリンパスは理化学研究所と共同で,画像取得時間を大幅に短縮し生きた細胞内の微細構造の観察を可能にする,超解像蛍光顕微鏡法の新技術を開発した(ニュースリリース)。
オリンパスは理化学研究所と共同で,画像取得時間を大幅に短縮し生きた細胞内の微細構造の観察を可能にする,超解像蛍光顕微鏡法の新技術を開発した(ニュースリリース)。
光学顕微鏡の空間分解能の限界は用いる光の波長の半分程度(回折限界)であり,可視光を用いて観察する限りは,光学顕微鏡では200nmより細かい構造の観察はできないと長い間信じられてきた。しかし,回折限界を超えた空間分解能を目指す超解像蛍光顕微鏡の開発が2000年代から活発となり,100nmあるいはそれ以下の空間分解能が達成されてきている。
ただし,従来の超解像顕微鏡はどれも撮像に時間がかかるため,生きたまま細胞を観察するライブセルイメージングには不向きだった。そこで,研究グループはライブセルイメージングを可能にする1/100秒の時間分解能をもつ超解像顕微鏡の技術開発を目指した。
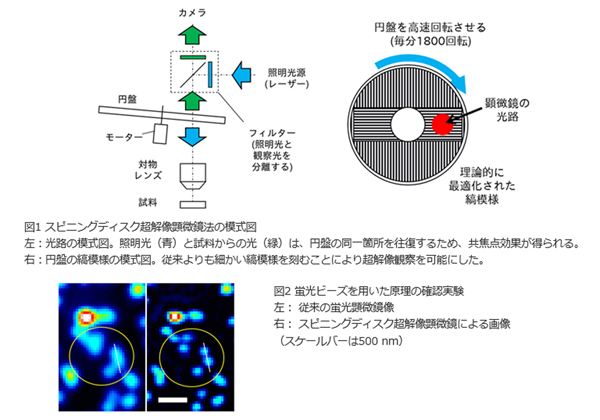
従来の超解像蛍光顕微鏡法のひとつである構造化照明法に注目して解析を進めた結果,構造化照明法と共焦点顕微鏡の結像に理論的類似性があることが明らかになった。そこで,同社製のディスク走査型顕微鏡ユニット(DSU)を用いて検討し,回転円盤の縞模様などを工夫すれば構造化照明法と同等の超解像が得られることがわかった。これを「スピニングディスク超解像顕微鏡法(SDSRM:Spinning Disk Super-Resolution Microscopy)」と名付けた。
次に,蛍光ビーズを用いた原理確認実験により,理論どおりに100nm程度の空間分解能が達成されることを確認した。さらに,カメラと照明光源を高速撮影に適したものに交換することで,最高1/100秒のシャッター速度(時間分解能)で,生きた細胞内の微細構造を100nmの空間分解能で観察することに成功した。
スピニングディスク超解像顕微鏡法の開発により,生きた細胞の中の微細な構造が動く様子を観察することが可能となった。この顕微鏡法は,スピニングディスク共焦点顕微鏡の応用であるため,これまでの超解像蛍光顕微鏡に比べて導入は容易。また,この顕微鏡法の原理を発展させることで,他の共焦点顕微鏡への適用も原理的に可能と考えられるという。





























