名古屋大学は,東京大学および大阪大学との共同研究で人間の体表面及び器官表面を構成する細胞同士の構造的なつながりを解析に成功。これまで謎とされてきた,恒常性(栄養吸収やイオン環境保 持などの生体機能)を保つ働きを持つ分子が,どのような形をして、どのように重合することで,細胞間の隙間を通過するイオンの種類などを制御しているのか を解明した。
多細胞生物は,体表面および器官表面を上皮細胞と呼ばれるシート状の細胞でシールすることにより,体の内を外界の環境から守っている。上皮細胞シートが イオンや小分子に対する隔壁として機能するために,上皮細胞は上下の極性を持ち,その側面には隣接する細胞との間に複数の接着装置が存在する。
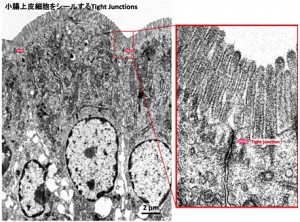
例えば、 小腸上皮細胞では細胞の外側(小腸の管の側:アピカル側)に近い細胞部分にタイトジャンクションと呼ばれる細胞間接着構造が形成されている。タイトジャンクションの存在自体は電子顕微鏡観察により古くから知られており,膜表面を観察するとタイトジャンクションストランドと呼ばれる網目状の構造 が見られ,この構造体が隣接する細胞の膜表面を近接させ,物質の通過を制限していると考えられていた。
このタイトジャンクションストランドの 基本骨格を構成する膜内在性タンパク質の分子実体は1998年に同定され,「クローディン」と名付けられた。クローディン同士は,タイトジャンクションにおいて同一膜平面内で線状に重合するとともに,隣接する細胞間で接着するというユニークな機能 によりタイトジャンクションストランドを形成するが,この分子がどのような形をしていて,どのように重合しているのかは,これまで全く明らかになっていなかった。
今回,マウス由来のクローディンの1つであるクローディン-15を,特殊な脂質環境中で結晶化し,大型放射光施設SPring-8のX線マイクロビーム を利用して回折データを取得することにより,その結晶構造を2.4Å分解能で決定する事に成功した。
今回の初めて明らかになった,タイトジャンクションストランドの基本単位としてのクローディンの構造は,今後,実際の生体内でのより高次 の重合体構造を解析する基礎となるとともに,多細胞生物の恒常性維持の根幹であるバリア機能についての理解を深め,新たな研究を促す事が期待される。
タイトジャンクションによるバリア機能は,血液脳関門における血管内皮細胞間隙の物理的障壁としても顕著であり,この分子が関わる疾病の理解を進めると ともに,タイトジャンクションの機能を制御することにより,これまで制御は不可能と思われていた脳への薬剤の浸透制御を可能にする新規薬剤送達方法をはじ めとする,革新的創薬技術の開発につながることが期待される。
詳しくはNEDOニュースリリースへ。