自然科学研究機構・生理学研究所教授の池中一裕氏と滋賀医科大学教授の等誠司氏のグループは,エピゲノム修飾因子であるBre1aが神経幹細胞の増殖と分化を制御していることを発見した。脳腫瘍の1つであるグリオーマでも,この分子メカニズムが働いていると推定され,その治療技術の進歩にも期待ができる成果。
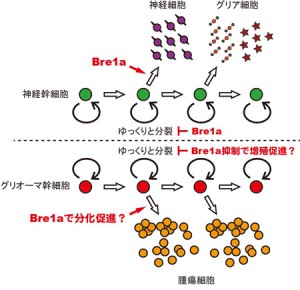
神経幹細胞は,胎児期の脳で大量の神経細胞・グリア細胞を産み出すとともに,自分自身を維持するように,増殖と分化のバランスをうまく調節する必要がある。研究グループは,神経幹細胞の細胞周期と分化のバランスをとるために,両方を調節している因子としてBre1aという遺伝子を同定した。Bre1aは,細胞のDNAが巻き付いているヒストンと呼ばれるタンパク質の1つ,H2Bをユビキチン化することが知られていた。
Bre1aは胎児期の脳の多くの細胞で発現しているが,ごく一部の細胞では発現低下しており,これらの細胞ではヒストンH2Bのユビキチン化も低下していた。そこで研究グループは,胎児期の神経幹細胞で人為的にBre1aの発現を低下させたところ,神経幹細胞の分化が抑制されることがわかった。
また,ここに神経幹細胞の分化抑制に重要だと考えられている,Hes5という別の遺伝子の活性化が働いていることも見出した。同時に,Bre1aの発現が低下した神経幹細胞では,細胞周期が伸びて,分裂がゆっくりになっていることを発見した。
脳腫瘍でも,グリオーマ幹細胞という腫瘍の元になる細胞の存在が,抗がん剤に対する抵抗性の原因の1つだと考えられており,今回の成果によって,グリオーマの治療戦略を考える際にも,この分子メカニズムが標的の1つとして重要だと推定されることになる。
詳しくはこちら。