九州大学大学院准教授の角田佳充氏は、宮崎大学農学部教授の水光正仁氏、教授の榊原陽一氏らとの共同研究で、ヒトタンパク質チロシン硫酸転移酵素とターゲットタンパク質の複合体の立体構造を決定、酵素の作用メカニズムを解明した。
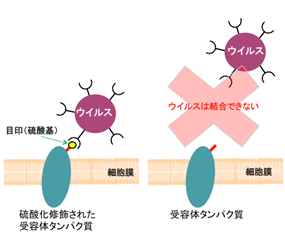
この酵素は、種々のタンパク質に硫酸基をつける働きをし、タンパク質につけられた硫酸基は、様々な生体防御機構に関係する一方で、ウイルスがヒト細胞に侵入する目印にも使われる。
角田氏らは、タンパク質チロシン硫酸転移酵素と、ターゲットタンパク質が結合している状態の構造を、フォトンファクトリーのビームラインNW12AとSPring-8を用いてX線結晶構造解析で調べた。その結果、この酵素は二量体を形成し、二量体の間につくられる奥深い溝の部分がターゲットとなるタンパク質のチロシン残基部分と結合し、硫酸基をつけていることがわかりました。またこの構造から、硫酸基をつけるタンパク質とつけないタンパク質を、タンパク質の柔軟性の違いと電荷による相互作用いて選別していることも明らかになった。この硫酸基をつけるメカニズムが解明されたことで、抗ウイルス薬を含めた新しい医薬品の開発が期待される。
詳しくはこちら。