1. はじめに
治療医療から予防医療への転換が進む昨今において,高感度バイオセンシング法の需要が一層高まりつつある。疾病由来の生体分子(バイオマーカー)を従来よりも高感度に検出することによって,疾患の超早期発見が可能となり,健康寿命の延伸に繋がることが期待されている。また,ウィズコロナ・ポストコロナ時代において,新型コロナウイルス感染症の拡大防止策としても,バイオセンシングの高感度化が求められている。
筆者らは,高感度医療診断応用を目指し,金属や誘電体からなるナノ構造の電磁場光共鳴を活用した光バイオセンサーの開発をおこなっている。とくに,可視から中赤外までの波長域の光を特異的に増幅する様々なナノ構造体を設計・作製し,バイオマーカーの光学応答(蛍光・ラマン散乱・赤外吸収など)を高感度検出する手法を開発している。また,光の回折限界を超えた空間分解能で生体材料を無染色・無染色イメージング分析する技術も開発し,高精度イメージング診断への応用も図っている。本コーナーでは,筆者らが取り組む高感度・高分解能光診断技術について,最近の成果を交えながら紹介する。
2. 金属ナノ粒子を用いた新型コロナウイルスの高感度検出
光バイオセンシングといえば,表面プラズモン共鳴(Surface Plasmon Resonance:SPR)が定番である。抗体を修飾した金薄膜表面に励起される伝搬型表面プラズモンを利用することによって,抗原-抗体反応時の反射光の変化量から抗原濃度を測定することが可能である1)。
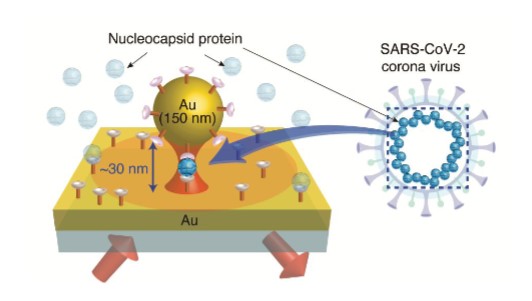
SPRセンシングの高感度化の一策として,2次抗体を修飾した金ナノ粒子を用いる手法が知られている。抗原抗体反応時に金ナノ粒子が抗原を介して金基板に吸着すると,金基板と金粒子間の間隙で光が強く局在・増幅され,その光増強効果によってSPRの感度が向上する。金属間の間隙に誘起される局在表面プラズモンはギャップモードプラズモンと呼ばれ,その共鳴波長と光増強度は間隙の大きさによって決まる。間隙の大きさは抗原と抗体のサイズ相当であり,新型コロナウイルス中に豊富に含まれるNタンパク質を検出する場合は,間隙のサイズは30nm程度になる(図1)。
通常,30nm程度の間隙ではギャップモードプラズモンによる高い増強効果は期待できないが,150nm程度の直径の金ナノ粒子を用いると,ギャップモードの共鳴波長が励起波長に近づくため,SPRの感度が30nmの金ナノ粒子を用いる場合と比べて1桁近く向上することを我々は見出した2)。実際に,fMレベルの感度で新型コロナウイルスのNタンパク質を検出することに成功した。