東北大学と日本医科大学は,光で色や構造が変化するフォトクロミック化合物と呼ばれる分子を用いて,生きた細胞内の蛋白質の局在を迅速かつ定量的に操作する技術を開発した(ニュースリリース)。
顕微鏡で観察しながら,光を当てて生体分子や細胞の機能を操作する技術が注目を集めている。近年では,光切断可能な保護基で結合活性を一次的に抑え,光照射で二量化を誘導できるケージドCID法が開発され,細胞内蛋白質の動態を光で制御する新しい技術として注目されている。
しかし,ケージドCID法は,光遺伝学的手法とは異なり,原理的に二量化・解離を繰り返すことができないという技術的な制約があった。そこで研究では,波長が異なる光を交互にあてることで,蛋白質の二量化と解離を繰り返し制御可能な「フォトクロミックCID法」を世界で初めて開発した。
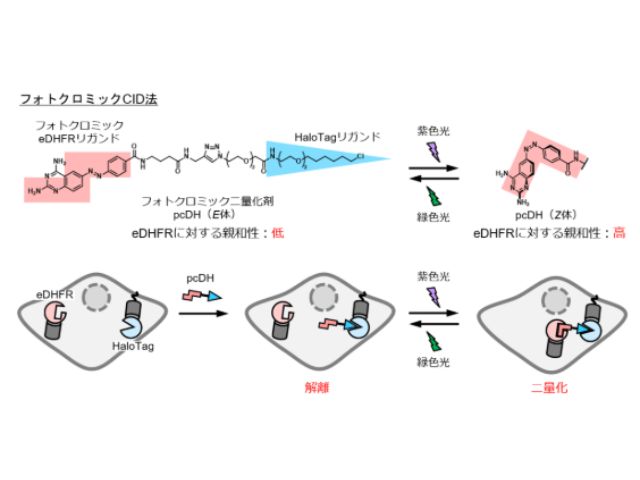
フォトクロミックCID 法は,eDHFR(18 kDa)と HaloTag(34 kDa)と呼ばれる二種類の蛋白質タグ,ならびにそれらを光照射で二量化・解離させるフォトクロミック二量化剤(pcDH)から構成される。
pcDHは,細胞を培養したディッシュに添加すると,細胞内に発現させたHaloTag蛋白質と速やかに共有結合する。pcDHの構造中にはeDHFRに結合するフォトクロミック化合物構造が含まれており,光を当てる前および緑色光を照射した場合はE体(トランス体)として存在している。
この状態ではeDHFR への親和性は低いため,HaloTagとeDHFRは二量体を作らない。一方,紫色光を照射するとpcDHはZ体(シス体)となり,eDHFRに対する結合親和性が高まり,eDHFRとHaloTagの二量化が起こる。この機構は何度も繰り返し可能で,紫色光と緑色光による二量化と解離の可逆制御が可能になった。
このシステムを用いて,蛋白質の細胞内局在の光制御を検討したところ,紫色光による二量化と緑色光による解離に必要な半反応時間はそれぞれ0.78秒と0.3秒未満であり,報告されている光遺伝学的手法よりも高速に制御できることがわかった。
細胞内シグナル伝達の分子機構解明に対するフォトクロミックCID法の有用性を検証するために,マイトファジーの光操作に応用したところ,マイトファジーのシグナル伝達には一過性の環境変化等には影響を受けにくいようなシステムの堅牢性が備わっていることが示唆された。
研究グループは,開発したフォトクロミックCID法は,蛋白質の細胞内局在を迅速,可逆的かつ定量的に制御できる点で世界最高レベルの技術だとしている。