名古屋大学,東京大学,理化学研究所は,高い耐光性と細胞膜透過性を兼ね備えたライブセルイメージング用近赤外蛍光標識剤の開発に成功した(ニュースリリース)。
近赤外領域の光は生体に対する毒性が低く,自家蛍光の影響も少ないため,生細胞の長時間イメージングに適している。しかし,近赤外蛍光色素の水溶性の低さと化学的不安定性が問題となっていた。
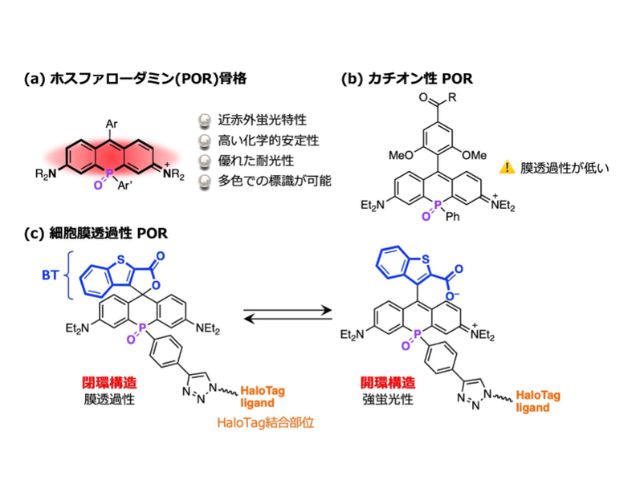
これを解決するため,研究グループはリン元素を含むホスファローダミン(POR)骨格を開発しているが,細胞膜の透過性に課題があった。
研究グループは,この問題に対処するため,新たな近赤外色素を開発した。この色素は,細胞膜透過性を高める2-カルボキシ-ベンゾ[b]チオフェン-3-イル(BT)基の導入により,HaloTagタンパク質と共有結合できる構造を持つ。
これにより,特定のオルガネラを標的とする蛍光標識が可能になった。特に,新色素の立体異性体であるtrans-1は,核のみを特異的に標識し,優れた細胞膜透過性を示した。
trans-1が優れたオルガネラ標識能を有することから,生細胞の蛍光イメージングへの応用を検証した。POR骨格は光に対する安定性と化学的な安定性が高いことに加え,近赤外光で励起できることから,生理学的な条件での生細胞の動態を長時間に渡って観察することが可能。
実際に,ヒストンH2Bを標識した細胞において,90秒毎に25時間かけて撮影することができ,核分裂過程を追跡することに成功した。
優れた耐光性は超解像イメージングにおいても有効となる。研究グループは,スピニングディスク超解像顕微鏡法を用いて細胞内の微細な構造の三次元動態を追跡した。
小胞体と微小管をそれぞれtrans-1と市販の微小管標識剤SiR-Tubulinで染色し,イメージ画像を異なる波長で同時かつ連続的に取得することにより,三次元+時間+波長の超解像5次元イメージングを実現した。これにより,小胞体膜のネットワークと微小管のネットワークがどのように連結していくのかという動きを捉えることに成功した。
研究グループはこの成果について,近赤外蛍光標識剤の開発に新たな道を開き,細胞イメージング研究における低侵襲で長時間の観察を可能にするものだとする。
立体化学の理解に基づいたこのアプローチは,薬物の膜透過性を高める研究や創薬開発にも応用可能であり,医学や生命科学分野におけるさらなる進展が期待されるとしている。