 長崎大学大の研究グループは,あらゆる核酸医薬に対し「光反応性」の付与を実現する新たな技術を開発した(ニュースリリース)。
長崎大学大の研究グループは,あらゆる核酸医薬に対し「光反応性」の付与を実現する新たな技術を開発した(ニュースリリース)。
核酸医薬は,従来の医薬品では標的にできなかった遺伝子そのものを標的に出来るという点で,新たな創薬モダリティとして注目を集めている。これまではmRNAを標的とした核酸医薬品が上市されてきたが,近年,遺伝子の本体であるDNAを直接標的とした核酸医薬が注目を集めている。
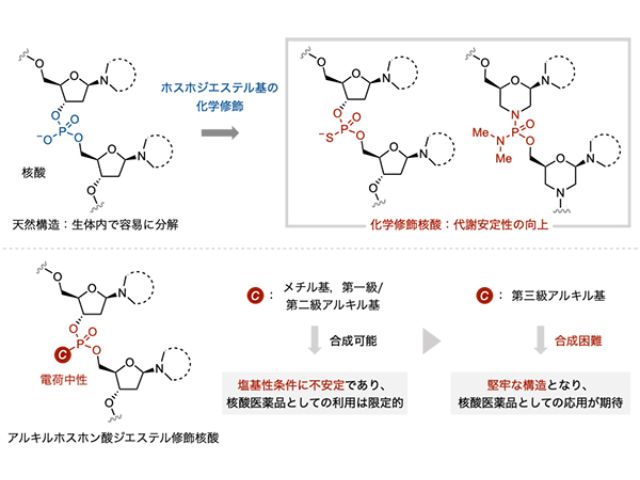
DNAは二重らせん構造を形成しているため,これに対し三重鎖形成して結合する核酸医薬が必要になるが,二重鎖DNAに対して強固に結合する人工核酸の開発が特に求められており,様々な人工核酸が開発されてきた。
これまでに研究グループは,光照射によって標的遺伝子と架橋する光架橋性核酸医薬を開発してきた。光架橋性分子として,皮膚病の光線治療にも用いられている天然化合物である「Psoralen(ソラレン)」に着目し,これを導入した人工核酸を開発し,核酸医薬としての有効性を検証してきた。
光架橋性核酸医薬は標的遺伝子と共有結合を介して結合するため,不可逆的で強固な結合形態を実現する。一方でこの核酸医薬の合成には,特殊な試薬や手法(固相ホスホロアミダイト法)が必要であり,DNA自動合成機を所有していない一般の実験室で合成することは極めて困難だった。
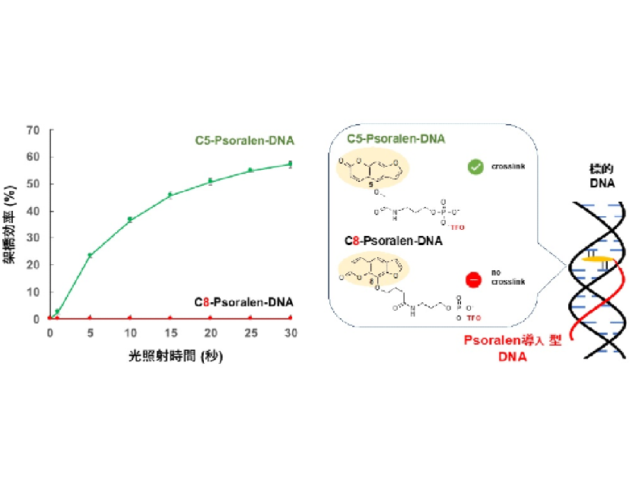
そこで研究グループは,様々な核酸医薬に簡便に光架橋性を付与することが可能な「新たな光架橋性試薬(Psoralen-NHS)」を開発した。Psoralen-NHSは,アミノ基を有する分子と混ぜるだけで,原理的にどの分子にもPsoralenを導入することが可能だとする。
研究グループはこのPsoralen-NHSの化学構造をさらに精査し,核酸へ導入するリンカーの導入部位によって,二重鎖DNAに対する光架橋性を大きく向上させることに成功した。
この成果は,光を用いた次世代型の核酸医薬として,また,ゲノムDNAの情報を書き換える「ゲノム編集技術」への展開が期待されるもの。光を外部刺激として用いるため,遺伝子発現の時空間的な制御も可能となるため,新たな遺伝子解析ツールとしての活用も期待される。
研究グループは,核酸医薬だけでなく,アミノ基を有する様々な分子に光架橋性を付与することも実現でる成果だとしている。