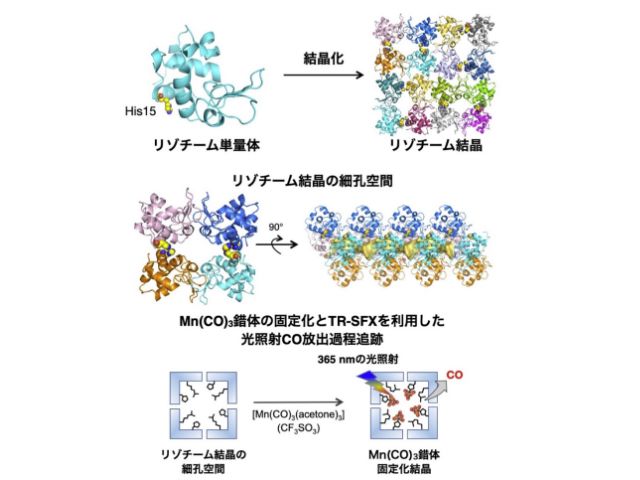
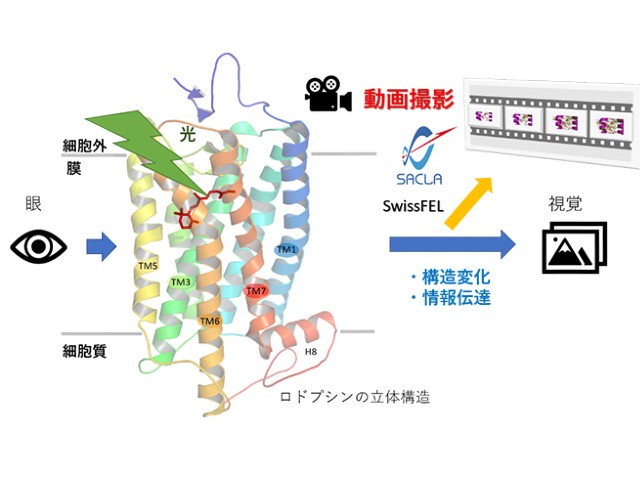
 理化学研究所(理研),京都大学,東北大学,高輝度光科学研究センターは,X線自由電子レーザー(XFEL)を用いて,視覚に関わるタンパク質であるロドプシンが光刺激によって1ピコ秒~100ピコ秒という超高速で変化する過程を,原子の動きまで克明に動画として捉えることに成功した(ニュースリリース)。
理化学研究所(理研),京都大学,東北大学,高輝度光科学研究センターは,X線自由電子レーザー(XFEL)を用いて,視覚に関わるタンパク質であるロドプシンが光刺激によって1ピコ秒~100ピコ秒という超高速で変化する過程を,原子の動きまで克明に動画として捉えることに成功した(ニュースリリース)。
眼の網膜に存在する膜タンパク質であるロドプシンは,ビタミンAの誘導体であるレチナールという共役アルデヒドを発色団として含んでおり,高感度で光を感受できることから,薄暗い環境において物を見る役割(暗所視)を果たす。
光を受けたロドプシンは,レチナールが立体選択的に異性化することで,タンパク質の構造変化を誘起し,それが細胞内へ信号として伝わって最終的に生物は”物を見る”ことができる。
ロドプシンが光によってどのように構造を変化させるのか,その詳細なメカニズムに興味が持たれてきたが,試料の入手が難しく,微弱な光であっても結晶が損傷するなどのさまざまな困難が実験の障壁となっていた。
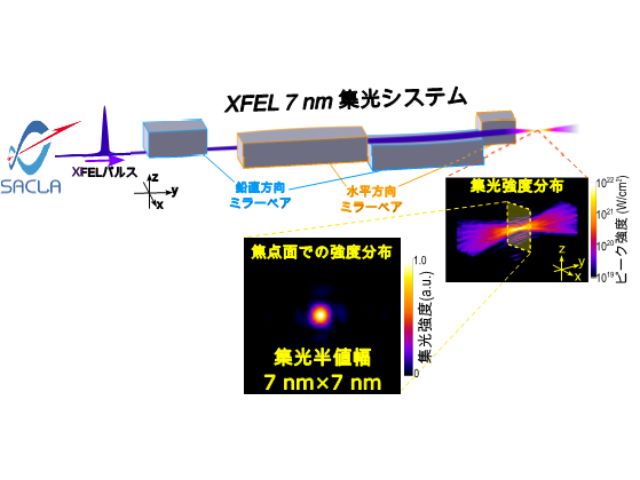
一般的に,タンパク質の立体構造を原子レベルで可視化するための強力な手段として,X線結晶構造解析がある。しかし,観察される構造は静止した状態のみで,素早く変化する過程を捉えることは不可能だったが,XFELの登場により,フェムト秒に至る時間分解能,かつ原子分解能でタンパク質の動きを捉えることが可能になった。
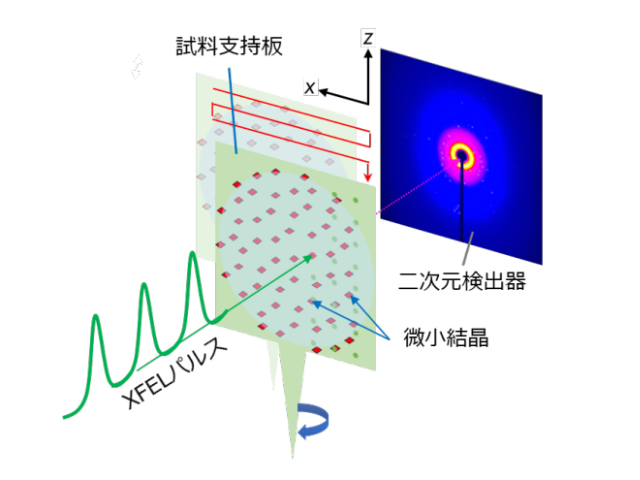
研究グループは,ウシ由来のロドプシンの結晶に光を照射して反応を開始させた後,1ピコ秒から100ピコ秒にかけて測定を行ない,時間ごとに変わっていくタンパク質の構造変化を動画撮影した。撮影した中間体の構造は,1.8Åという高い空間分解能で決定することに成功した。
特にレチナールは光照射1ピコ秒後に異性化し,20番目のメチル基が大きく回転して歪んだ形をとることが明らかになった。また,光照射前のレチナールとその周辺アミノ酸残基の間に観察された多くの相互作用は,レチナールが光照射により歪んだ全トランス型を形成すると,大半の相互作用が弱められた状態になった。
特に,情報伝達に関わるGタンパク質の結合に重要な3番目のヘリックス(TM3)とレチナールとの相互作用が弱くなることが分かり,こうした構造変化が視覚のメカニズムに関与することが明らかになった。
この成果は,視覚の初期段階やそのメカニズムを理解する上で重要な知見となるもの。研究グループは,今回用いた手法が,光で反応するさまざまなタンパク質の構造変化を捉え,仕組みを明らかにできるとしている。