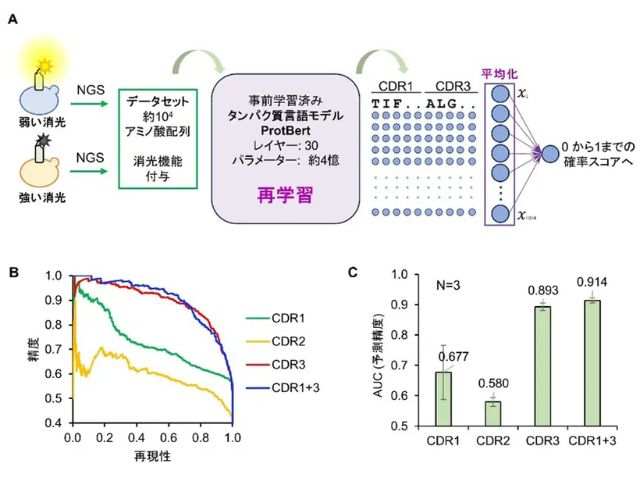
 東北大学の研究グループは,自己会合・解消機構に基づく新たなエクソソーム検出用蛍光プローブ(ApoC-TRC12)の開発に成功した(ニュースリリース)。
東北大学の研究グループは,自己会合・解消機構に基づく新たなエクソソーム検出用蛍光プローブ(ApoC-TRC12)の開発に成功した(ニュースリリース)。
エクソソームはほぼ全ての細胞が放出する細胞外小胞(直径50-150nm程度)で,細胞の恒常性維持やガンなどの疾患発症など多様な生命現象に深く関与している。エクソソームの機能理解や医療応用に向けて,エクソソームの検出技術開発が必要不可欠とされている。
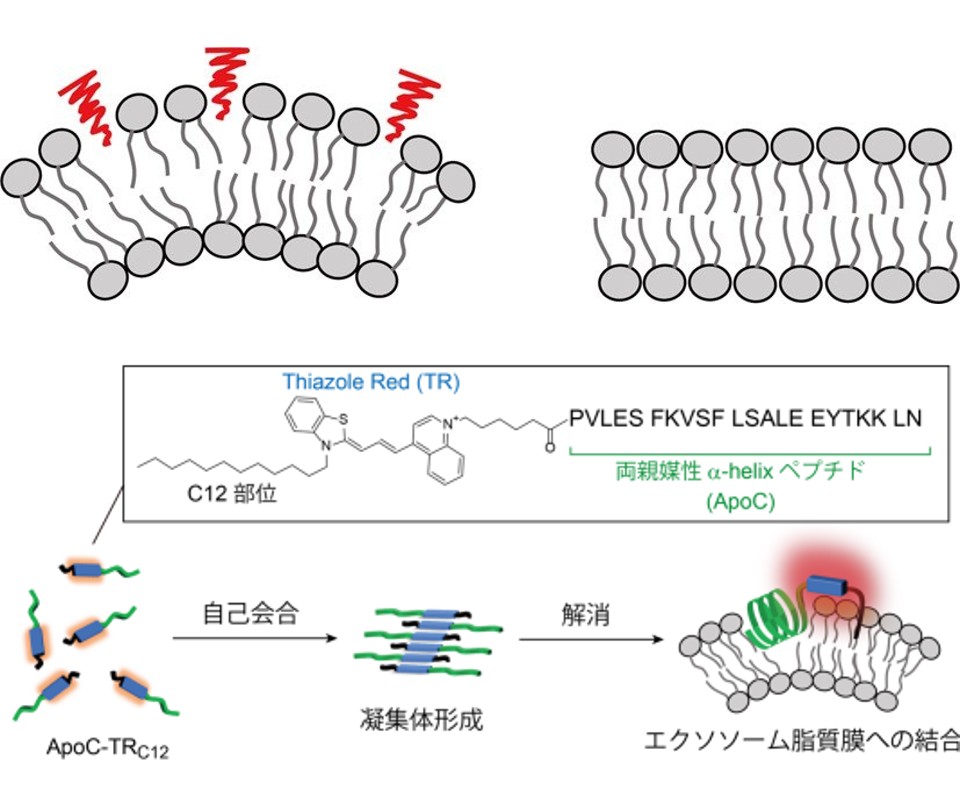
研究グループは長い炭素鎖(C12)を導入したシアニン色素Thiazole Red(TR)を蛍光応答部位として活用する蛍光プローブ(ApoC-TRC12)を新たに設計・合成した。ApoC-TRC12は自己会合を介して凝集体を形成することでTR単体由来の蛍光が著しく抑制されることが分かった。
ここに,エクソソームモデルとして合成した小胞(直径130nm)を添加するとプローブがエクソソーム脂質膜に結合するために,形成した凝集体は解消されプローブ結合に伴いTR部位の蛍光強度が増大する。
長い炭素鎖を持たないコントロールプローブ(ApoC-TR)との比較から,TR部位に導入した炭素鎖が自己会合機能を促進することで自己会合・凝集機構に基づく優れた蛍光応答能の発現につながることが分かった。また長い炭素鎖の導入はそれ自身が疎水性相互作用を介して脂質膜に挿入されることで,プローブの結合力を強化させる役割を持つことも分かった。
ApoC-TRC12はエクソソームサイズの小胞に対して,世界最強の結合力(解離定数Kd=0.37µM)を示すことを明らかにした(既存プローブ:Kd=5-100µM)。ApoC-TRC12を用いて白血病細胞株(K562)由来エクソソーム検出に適用したところ,結合に伴い優れた蛍光応答を示し,検出限界は3.5×103個/µLとなり,先行研究で開発したApoC-NRと比べて2桁も高い検出感度を実現した。
さらに,ApoC-TRC12は異なる細胞(肺がん細胞株;A549)由来のエクソソームに対しても2.1×103個/µLと高い検出感度を示すことから,様々な種類のエクソソームに対して高感度解析が可能だという。またApoC-TRC12は市販されているエクソソーム膜結合性蛍光試薬(MemGlow640)と比較しても高い検出感度を有することが分かった。
研究グループはこの成果について,自己会合・凝集機構に基づく分子設計がエクソソーム脂質膜結合性蛍光プローブに有用であることを示すとともに,エクソソーム研究の基礎と応用に向けた基盤技術の開発に貢献するものだとしている。