 兵庫県立大学,理化学研究所(理研),佐賀大学,神戸大学は,生体触媒である酵素の反応途中を観るための新手法を開発し,一酸化窒素還元酵素(NOR)の反応機構の解明に迫った(ニュースリリース)。
兵庫県立大学,理化学研究所(理研),佐賀大学,神戸大学は,生体触媒である酵素の反応途中を観るための新手法を開発し,一酸化窒素還元酵素(NOR)の反応機構の解明に迫った(ニュースリリース)。
酵素は生体内において代謝や生合成に関わる化学反応を温和な条件下で行なうことができる触媒であるため,酵素が持つ高効率の仕組みを解明することは,生命現象の理解だけでなく,高機能の触媒を設計するうえでも重要となる。
酵素が機能する仕組みを理解するためには,酵素の反応途中にみられる反応中間体を観測することが必要だが,酵素の反応中間体は,マイクロ秒からミリ秒程度の短い時間で消失してしまうため,その観測は容易ではない。
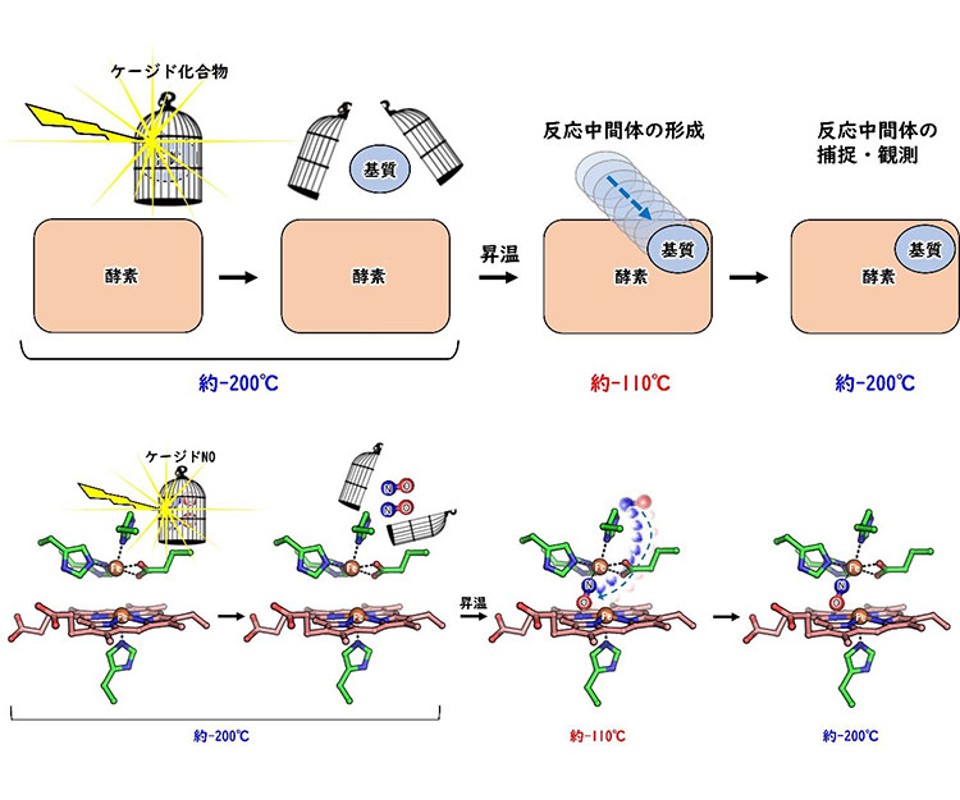
研究グループは,ケージド化合物を利用して,酵素の反応中間体を捕捉・観測する新たな手法を開発した。この手法では,酵素とケージド化合物を混合し,凍結する。
液体窒素中(約-200℃)で,試料に光を照射するとケージド化合物から基質が放出されるが,基質は試料中を拡散することができず,酵素反応は進行しない。試料の温度を徐々にあげていくと,-110℃程度で基質が凍結試料中をゆっくりと拡散できるようになり,室温では一瞬で消失する反応中間体を捕捉することが可能になる。
研究グループは,この手法を利用して,膜タンパク質である一酸化窒素還元酵素(NOR)の反応中間体の捕捉・観測に取り組んだ。NORは,緑膿菌などの病原菌が我々ヒトに感染した際に,免疫系が抗菌ガスとして産生する一酸化窒素(NO)を無毒化する酵素で,抗菌薬開発の標的になりうる重要な酵素。
NORはヘム鉄と非ヘム鉄からなる活性中心において,電子とプロトンを利用してNOを毒性の低い亜酸化窒素(N2O)へと還元する。光照射によりNORの基質であるNOを放出するケージドNOを利用して,液体窒素温度での光照射の後,昇温により酵素反応をゆっくりと進行させ,反応中間体を捕捉した。
ヘム鉄や非ヘム鉄にNOが結合した状態を詳しく検討することが可能な電子スピン共鳴(ESR)分光測定から,反応中間体は,非ヘム鉄にNOが結合した状態であることをつきとめた。この結果は,研究で開発した手法が酵素の反応中間体の観測に有用であることを示すものだという。
研究グループは,この成果が,今後の酵素やタンパク質が機能する仕組みを理解することに大きく貢献すると期待している。