 慶應義塾大学の研究グループは,消光団と呼ばれる無蛍光性の色素であるフェニルローダミン類の無蛍光メカニズムを初めて解明した(ニュースリリース)。
慶應義塾大学の研究グループは,消光団と呼ばれる無蛍光性の色素であるフェニルローダミン類の無蛍光メカニズムを初めて解明した(ニュースリリース)。
生体内での生命現象のリアルタイムかつ高感度な可視化のためには,細胞や身体の組織などを蛍光でマークし,生きたまま観察できる蛍光イメージングは無くてはならない技術となっている。
その蛍光イメージングを達成するためには,観察したい生体分子を認識して蛍光がoffからonへと切り替わる蛍光プローブが必要不可欠となる。一方,消光団は近傍の蛍光色素の蛍光を消すことができる色素分子であり,酵素活性を検出する蛍光プローブの一部として汎用されてきた。
これまでにこの消光団は蛍光プローブの開発に使用されてきた一方で,その無蛍光性のメカニズムについては明らかにされてこなかった。
そこで今回,誘導体の合成およびそれらの光学特性の精査,計算化学によって,その無蛍光性のメカニズムを初めて解明することに成功した。それによって,従来のものとは質的に異なる新たな蛍光プローブの分子設計法を提案することに成功した。
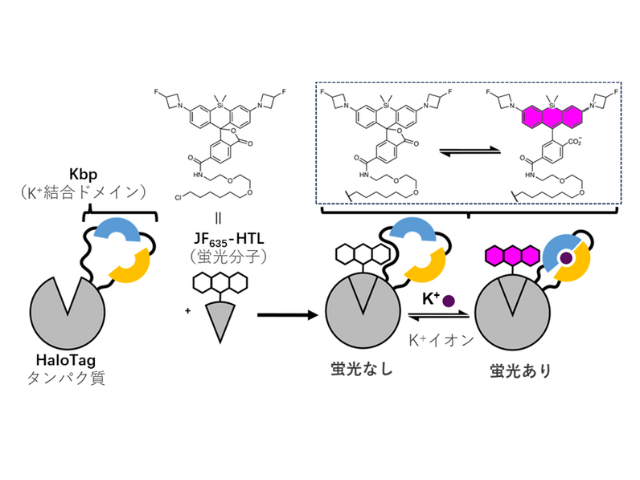
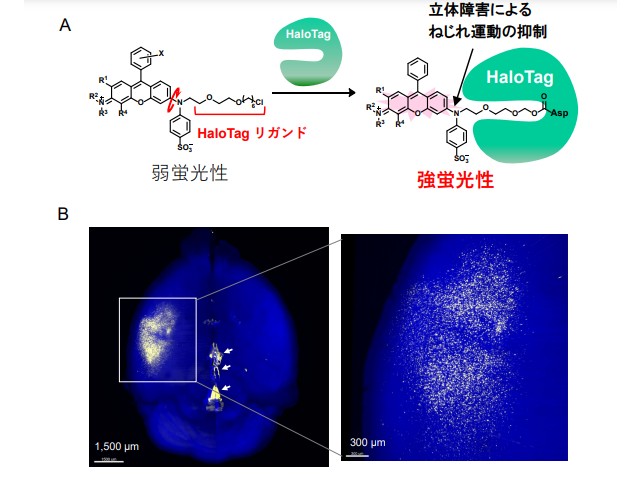
具体的な標的分子として,タグタンパク質として汎用されているHaloTagとSNAP-tagに着目。両者は,それぞれのリガンド構造を有する有機小分子と共有結合を形成する改変酵素であり,観察したい蛋白質とこれらタグ蛋白質を融合させることで標的蛋白質の局在や発現量の変化などを解析できる。
実際に,それぞれのリガンド構造を結合したローダミン類は,HaloTagおよびSNAP-tagと結合することで大きく蛍光が上昇し,実用的な蛍光プローブの開発に成功した。
新たに設計した蛍光プローブを使用することにより,培養細胞における細胞膜上のタグ蛋白質の発現をリアルタイムに蛍光イメージングできるだけでなく,マウス脳における神経細胞での,HaloTag蛋白質の発現を組織透明化技術と組み合わせることで,一細胞レベルで可視化することに成功した。
この分子設計法により,標的とする蛋白質へと結合するだけで蛍光を発する蛍光プローブの精密分子設計が可能となる。研究グループは,病態で高発現する蛋白質に結合して発蛍光する蛍光プローブを開発することで,病態の蛍光による迅速な可視化が可能になることが期待されるとしている。