 東京大学の研究グループは,緑色蛍光タンパク質(GFP)と合成低分子キレーターを組み合わせた新たなタイプの蛍光センサーを開発した(ニュースリリース)。
東京大学の研究グループは,緑色蛍光タンパク質(GFP)と合成低分子キレーターを組み合わせた新たなタイプの蛍光センサーを開発した(ニュースリリース)。
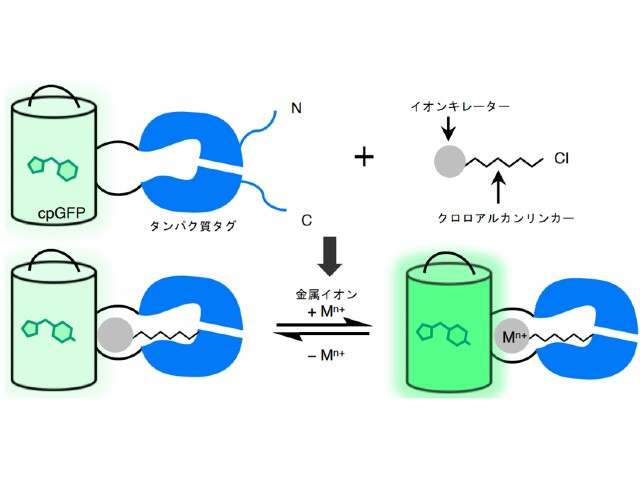
蛍光バイオセンサーは,生体内の特定の物質の濃度変化や生化学反応の進行に従ってその蛍光の強度や色を変える分子。研究グループは今回,検出対象(標的)に結合する部位が「低分子」で蛍光部位が「蛍光タンパク質」という,全く新しい化学遺伝学センサーのデザインを考案・実証した。
このデザインの持つ利点として,タンパク質を用いることで局在化や指向性進化法の使用が可能であり,かつ標的結合部位が低分子であるため検出対象や汎用性が広いことが挙げられる。
研究グループははまず,Ca2+と選択的に結合する合成低分子キレーター(BAPTA)とGFPとを組み合わせたCa2+センサーの開発に取組んだ。キレーターをGFPに結合させる方法として,特定の低分子(クロロアルカン)を取りこむことができるタンパク質タグとして知られるHaloTagを活用した。
キレーターとクロロアルカンの位置関係やリンカーの長さが異なる計10種類を合成し,それらと前述の32個のタンパク質,すなわち合計320通りの組み合わせについて,Ca2+の有無での蛍光強度変化を測定した結果,最も大きな変化を示した組み合わせにおいて,2.45倍の蛍光変化が見られた。
続いてタンパク質工学の手法である指向性進化法による性能の向上を試みた。特定の残基への選択的変異導入と,遺伝子全体にランダムに変異を加える手法とを組み合わせることで,最終的に蛍光変化が11.3倍まで向上した。この変異体はHaloGFP-Ca1と名付けられ,Ca2+センサーとして機能し,細胞内の局在化も可能なことがわかった。
Ca2+が結合している場合,BAPTAのカルボキシ基とタンパク質上の残基との相互作用が減少することが示され,これが蛍光変化の要因の一つと考えられた。HaloGFP-Ca1は蛍光変化が大きいもののCa2+への親和性が低いため,細胞内の生理的なCa2+濃度で十分な応答を示す新たな変異体HaloGFP-Ca0.2を開発した。
また,このデザインでナトリウムイオン(Na+)に対するセンサー開発にも成功し,センサーの設計手法がCa2+以外にも応用可能であることが示された。
研究グループは課題として,他のイオンや生体内分子を標的とするセンサーの開発や,より細胞実験に適した波長を持つ赤色蛍光タンパク質(RFP)を使用したセンサー開発などを挙げる。このような標的の充実と性能の向上によって新たな蛍光センサーが数多く生み出されるとしている。