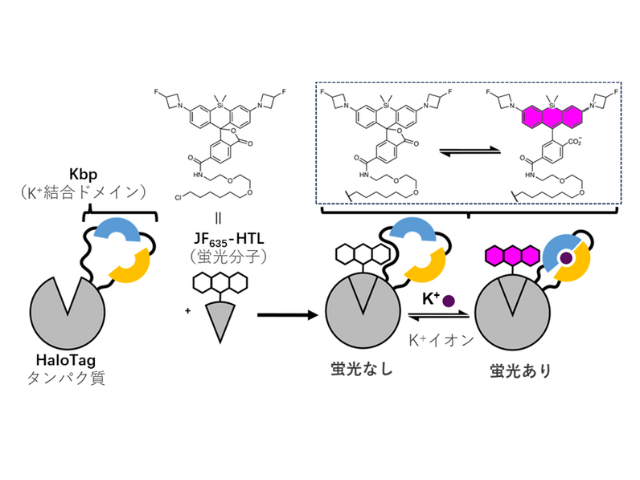
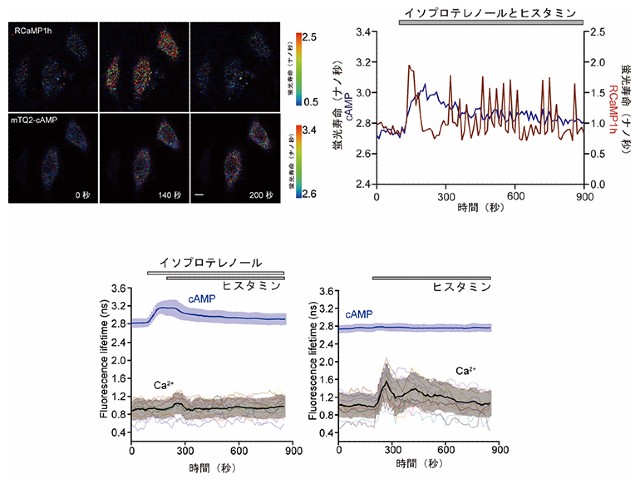
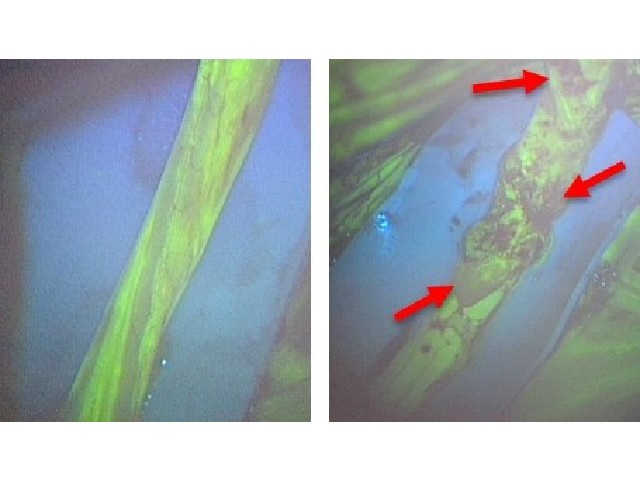
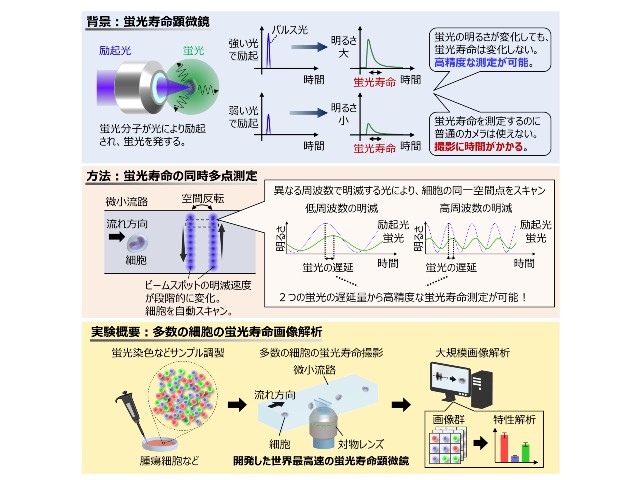
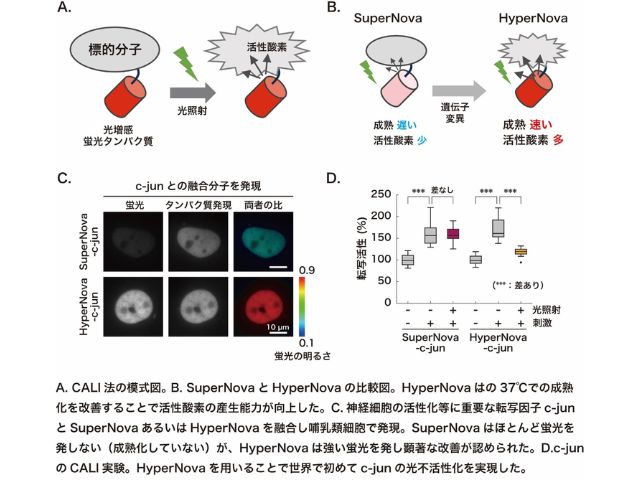
 理化学研究所(理研),産業技術総合研究所,福島県立医科大学,早稲田大学,東京大学は,ヒストンH3のメチル化とそれに伴うヘテロクロマチンタンパク質HP1αの相互作用を検出できる蛍光プローブの開発に成功した(ニュースリリース)。
理化学研究所(理研),産業技術総合研究所,福島県立医科大学,早稲田大学,東京大学は,ヒストンH3のメチル化とそれに伴うヘテロクロマチンタンパク質HP1αの相互作用を検出できる蛍光プローブの開発に成功した(ニュースリリース)。
「エピジェネティクス」と呼ばれる遺伝子の塩基配列によらない発現制御機構は,クロマチンの翻訳後修飾によって制御されており,DNAのメチル化やヒストンN末端のアセチル化,メチル化,リン酸化などがその役割の中心を担っていると考えられている。
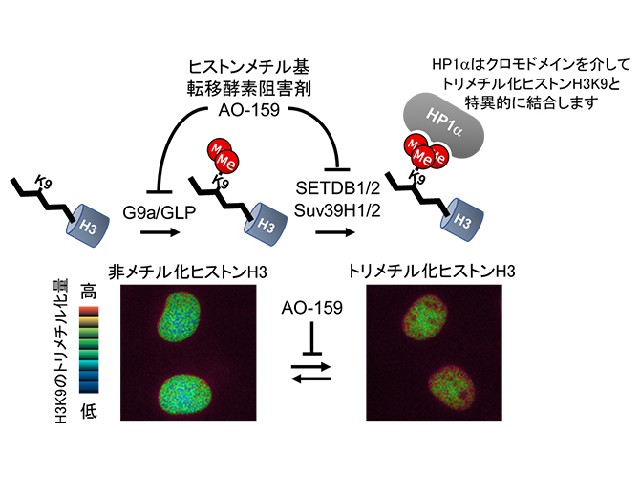
研究では,これらのヒストン修飾のうち,凝縮したクロマチン領域である「ヘテロクロマチン」の構造形成や転写抑制に関与している「ヒストンH3の9番目のリジン(H3K9)のメチル化」に着目した。
ヒストンH3K9は,ヒストンメチル基転移酵素(HMTase)であるG9a/GLPによってモノメチル化(H3K9me),ジメチル化(H3K9me2)され,Suv39H1/2とSETDB1/2によってトリメチル化(H3K9me3)される。
「ヘテロクロマチンタンパク質HP1α」は,H3K9me3を認識するクロモドメイン(CD)と二量体化に関わるクロモシャドウドメイン(CSD)からなり,高次ヘテロクロマチン構造の形成および細胞分裂の際の染色体分配に関わっている。
ヒストンH3K9の隣に位置する10番目のセリン(H3S10)のリン酸化は,細胞分裂のマーカーとして知られている。しかし,ヒストンH3のメチル化とリン酸化の相互作用など,複数の翻訳後修飾が細胞分裂の際にどのように変化し,それに伴うHP1αCDの結合がどのように変化しているかは,高い時間分解能での解析が不可能だったことから分かっていなかった。
これまで研究グループは,生きた1細胞内でのヒストンアセチル化修飾の動態を観察するための蛍光プローブ「Histac」を開発し,時間・空間分解能の高いレベルでのヒストンアセチル化の解析が可能になった。
今回,このHistacのコンセプトを基に,ヒストンメチル化の蛍光プローブの開発を行ない,細胞分裂過程におけるヒストンメチル化の変化を追跡することを目指した。
研究の結果,ヒストンH3の9番目のリジン(H3K9)のトリメチル化(H3K9me3)を可視化する蛍光プローブ「Hismet-HP1αCD」を作製し,このプローブを用いて,細胞分裂期におけるヒストンH3の翻訳後修飾のダイナミックな変動を明らかにした。
研究グループはこの成果が,生細胞内におけるヒストンメチル化の動態の追跡を可能にし,細胞内で作用するヒストンメチル基転移酵素(HMTase)阻害剤の開発に貢献するとしている。