 名古屋大学と独ミュンスター大学は,生きた細胞内で脂肪酸の代謝産物を染め分けることができる技術を開発した(ニュースリリース)。
名古屋大学と独ミュンスター大学は,生きた細胞内で脂肪酸の代謝産物を染め分けることができる技術を開発した(ニュースリリース)。
細胞内に取り込まれた脂肪酸は,様々な代謝過程を経由して細胞小器官(オルガネラ)に分布され,リン脂質合成やエネルギー産生などに利用される。脂肪酸代謝は生命維持活動と直結しており,代謝機能の異常と肥満・がん・肝炎などの多様な疾病との関連性も明らかになっている。
蛍光イメージング法は細胞内の脂肪酸代謝を観察するうえで有効な手法だが,代謝された脂肪酸がどのオルガネラにどの程度存在し,どのように利用されているのかを評価することは困難だった。
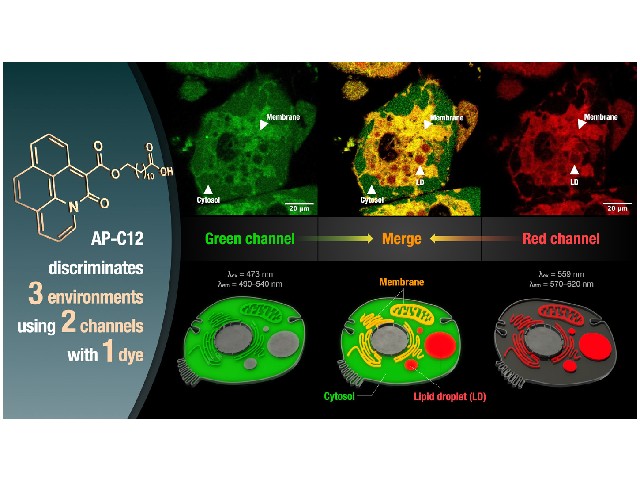
研究グループはこれまでに,蛍光色素アザピレン「AP-Me」を報告している。今回,AP-Meの分子サイズが小さいことに加え,蛍光特性が溶媒の極性に応答して変化する環境応答性を示すことに着目し,末端にアザピレン部位を有する長鎖脂肪酸AP-C12を開発した。
AP-C12を細胞に添加したところ,様々なオルガネラに分布される様子が蛍光イメージングにより観察された。細胞内におけるAP-C12代謝物の蛍光スペクトルを取得したところ,オルガネラにおける局所的な極性環境の違いに応答して蛍光スペクトルが変化することを見出した。
そこで研究グループは,2組の励起・検出波長のセット(緑チャンネルと赤チャンネル)を設定することで代謝産物の分布を染め分けできると考えた。緑チャンネルでは,高極性の細胞質や中極性の膜組織が検出されるのに対し,赤チャンネルでは,膜組織と低極性の脂肪滴が検出される。
したがって,これら2 つのチャンネルで得られる画像を重ね合わせると,両チャンネルで観察される膜組織を識別することができ,その結果,1つの蛍光色素で異なる3つの環境に存在する脂肪酸代謝産物を検出することが可能になった。
次に研究グループは,脂肪酸代謝過程を阻害する様々な薬剤を添加し,AP-C12の代謝産物の分布を可視化・分析することで,阻害剤の効果をパターン化することに成功した。また,肝臓ガン由来の細胞株であるHepG2細胞では、オートファジーによる脂肪分解よりもリパーゼによる脂肪滴の加水分解反応(リポリシス)が優先的に進行していることを明らかにした。
これらは従来の蛍光脂肪酸では達成できなかった分析法であり,AP-C12の脂肪酸代謝研究における有用性を強く示すものだという。研究グループは,この手法によって脂肪酸の代謝経路を可視化・分析できるようになることから,脂質代謝が関与する細胞機能研究や脂肪酸代謝を標的とした創薬に繋がるとしている。