 名古屋工業大学,関西医科大学,東北大学,京都大学は,全反射赤外分光法でGタンパク質共役型受容体(GPCR)の一つ,ムスカリン性アセチルコリン受容体(M2R)に対する,異なる薬剤効能を有する各種薬物結合に伴う構造変化を捉えることに成功し,それぞれの赤外差スペクトルにおけるアミド-Iバンドの変化が各種薬物間で分類できる可能性を見出した(ニュースリリース)。
名古屋工業大学,関西医科大学,東北大学,京都大学は,全反射赤外分光法でGタンパク質共役型受容体(GPCR)の一つ,ムスカリン性アセチルコリン受容体(M2R)に対する,異なる薬剤効能を有する各種薬物結合に伴う構造変化を捉えることに成功し,それぞれの赤外差スペクトルにおけるアミド-Iバンドの変化が各種薬物間で分類できる可能性を見出した(ニュースリリース)。
Gタンパク質共役型受容体(G Protein-Coupled Receptor: GPCR)は,薬物の結合などによって引き起こされる構造変化(活性化)が細胞内へと伝わることでシグナル伝達因子(Gタンパク質/アレスチン)を介したシグナル伝達を行なう。
GPCRの薬物はその生体活性によって,完全作動薬,飽和量薬物を投与しても部分的な活性しか示さない部分作動薬,基礎活性(薬物が結合していないGPCRが示す一定の弱い活性)を変化させない阻害薬,そして基礎活性さえも抑制する逆作動薬に分類される。
これらの薬剤効能の違いは”ligand efficacy”と呼ばれ,薬効に影響する。これまでにいくつかのGPCRについて異なるefficacyを有する薬物結合状態の構造が原子レベルで決定されている。しかしながら,全ての薬物がこれらの構造解析手法に適用されるわけではなかった。
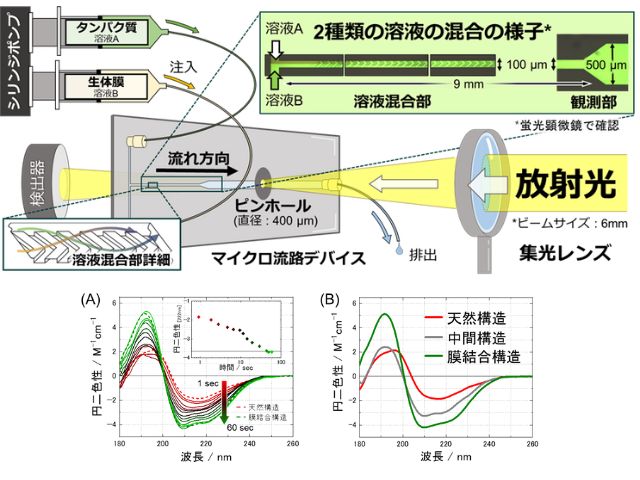
今回,研究グループは,独自に開発した全反射赤外分光法と2液交換系を組み合わせた測定手法を用いて,GPCRの一つであるM2Rに対する,異なるefficacyを有する各種薬物結合に伴う構造変化を捉えることに成功した。その結果,得られた各種薬物結合誘起差スペクトルにおける,α-ヘリックスのC=O伸縮振動バンドに対応するアミド-Iバンドの変化が,各種リガンド間で分類できる可能性を見出した。
さらに,それぞれの薬物に対し培養細胞を用いたGタンパク質活性評価を行なった結果,Gタンパク質活性の大きさと,赤外分光法から得たGタンパク質活性化度合いに相関性があることが分かり,全反射赤外分光法によって得られたアミド-Iのバンド変化がM2Rのligand efficacyを決めるプローブとなり得ることを示した。
この成果について研究グループは,全反射赤外分光法によって得られたアミド-Iのバンド変化がM2Rのligand efficacyを決めるプローブとなり得ることを示しただけでなく,従来の構造ベースの薬物結合ポケットを基盤とした薬剤設計指針とは異なる,相互作用解析から動的構造情報を抽出して薬効度を制御する,新たな薬剤設計指針の提示が期待されるとしている。