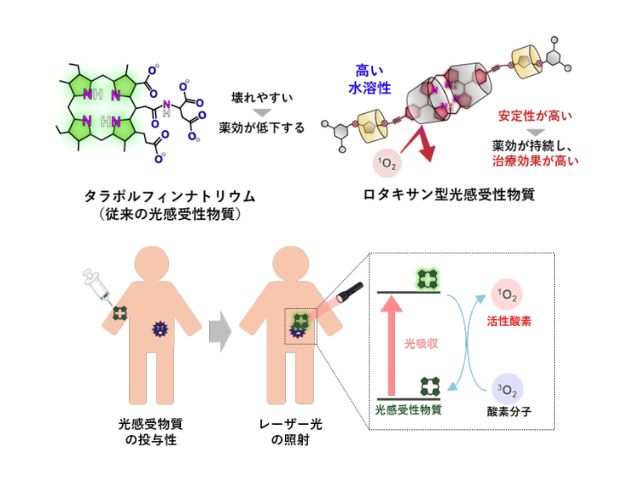
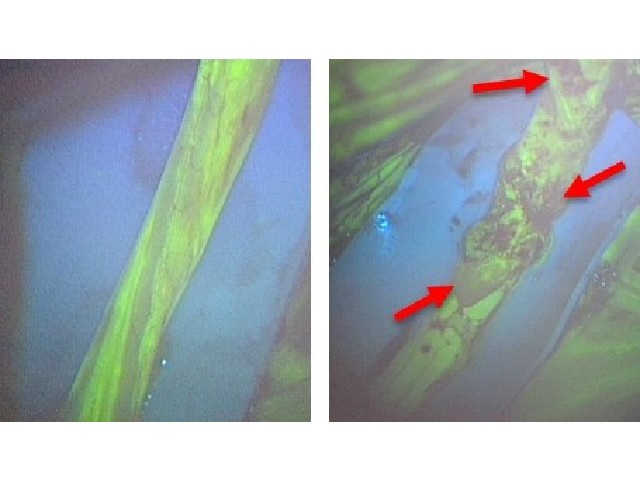
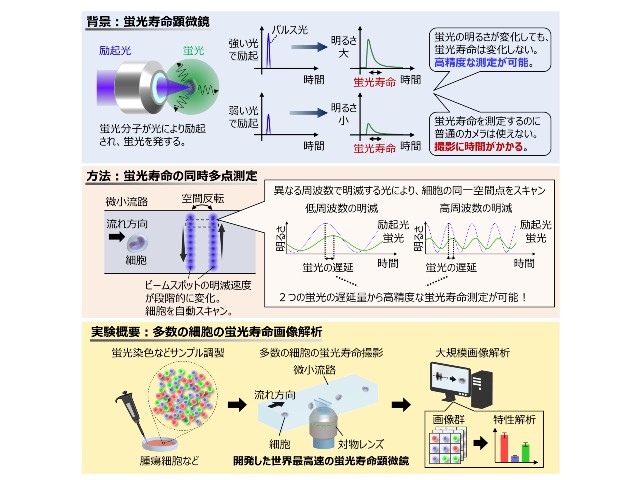
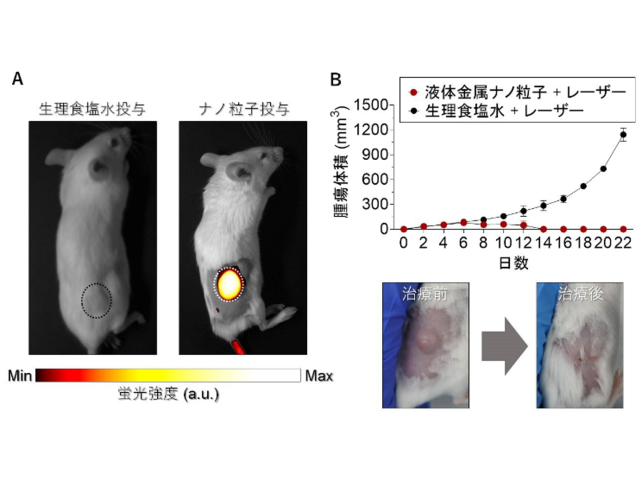
熊本大学,オジックテクノロジーズ,若林精機工業は,微量でもがん細胞を検知すると発光強度を増大する核酸分子デバイスを開発した(ニュースリリース)。
熊本大学,オジックテクノロジーズ,若林精機工業は,微量でもがん細胞を検知すると発光強度を増大する核酸分子デバイスを開発した(ニュースリリース)。
がんの転移は,原発腫瘍細胞組織から一部の腫瘍細胞が剥離し,血液やリンパ液の流れに乗り,体内の別の臓器に移動することで起こる。このように血流に乗って体内を循環している腫瘍細胞は,血中循環腫瘍細胞(Circulating Tumor Cell: CTC)と呼ばれている。
CTCは画像診断では確認されない微細ながんや,通常の腫瘍マーカーでは捉えるのが難しいとされる初期フェーズのがん患者においても確認されており,有用な診断マーカーとして着目されている。しかしながら,血液1mL中に約50億個の血球細胞が存在するのに対し,CTCはわずか数個〜数十個しか存在しないため,その検出は困難だった。
研究では,腫瘍細胞に応答して開始されるDNA複合体の連鎖反応によって,溶液全体が発光する仕組みを構築した。多くの固形腫瘍は細胞膜上にEpCAMという膜タンパクを高発現しており,これを腫瘍細胞の目印とした。
また,EpCAMを認識し,結合する素子として抗EpCAM DNAアプタマーを利用し,その末端に「タグ」となる任意のDNA配列を連結することで腫瘍細胞上にEpCAMを介して特異的に「タグ」を導入した。
特定の塩基配列を有するDNAが特定の高次構造を形成し,抗体のように標的と選択的かつ強固に結合することができる。このようなDNAをDNAアプタマーと呼ぶ。DNAアプタマーは,化学合成できることから安価に入手可能であり,免疫原性もないため,抗体に変わる次世代の分子認識素子として注目を集めている。
この「タグ」はトリガー,マスクと名付けられた二つの一本鎖DNAが形成する二本鎖DNAと選択的に反応し,トリガーが遊離するように設計されている。この遊離状態のトリガーは,発光シグナルを増幅する核酸複合体の連鎖反応(DNAサーキット)を開始することができるという。
そのため,この機構を用い,胃食道部がん患者や胃がん患者の血液1mL中に含まれるわずかなCTCを目視可能な程強い発光にて検出することに成功した。研究グループは今後,他のがん種の患者も含めて検証を続けて行くことで,将来的には簡便ながんの病態モニターや簡易診断への展望が期待されるとしている。
*