 東京大学,名古屋工業大学,名古屋大学は,X線結晶構造解析により光に応答して環状ヌクレオチドを分解するRh-PDEの立体構造を解明した(ニュースリリース)。
東京大学,名古屋工業大学,名古屋大学は,X線結晶構造解析により光に応答して環状ヌクレオチドを分解するRh-PDEの立体構造を解明した(ニュースリリース)。
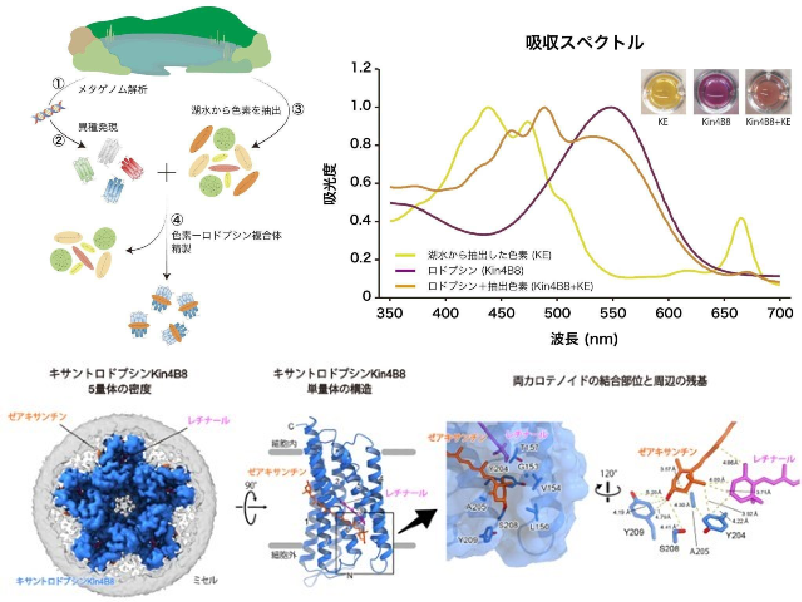
ヒトをはじめとする様々な生物はロドプシンと呼ばれるタンパク質を細胞膜に発現させ,環境からの光に応答している。襟べん毛虫と呼ばれる微生物もこのロドプシンタンパク質を持っており,光に応答してコロニーを反転させる。
この反応に関わるのは,ロドプシンホスホジエステラーゼ(Rh-PDE)と呼ばれるタンパク質。Rh-PDEは,光に応答する膜貫通部位と環状ヌクレオチドを分解する酵素部位からなる。
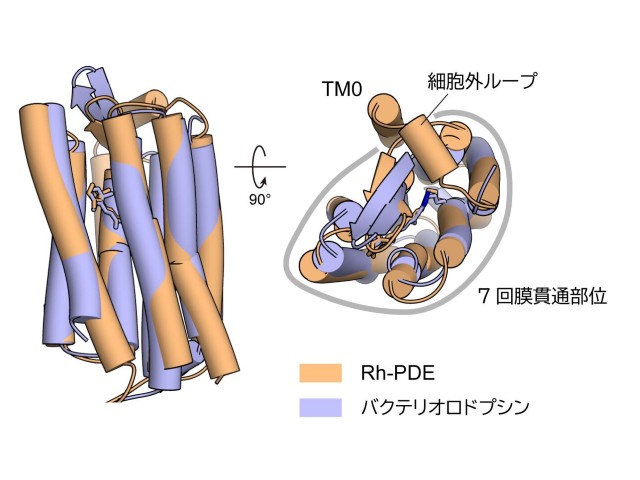
Rh-PDEの属すロドプシンファミリーは,これまで7回膜貫通型のものしかないと考えられてきたが,Rh-PDEのロドプシン部位は8回膜貫通であることが予測されていた。しかし,この1回余分に存在する膜貫通部位がどのような位置関係で存在するのか,またどのような役割を果たしているのかは分かっていなかった。
今回研究グループはX線結晶構造解析により,Rh-PDEの膜貫通部位の立体構造を明らかにした。Rh-PDEの膜貫通部位は,予測されていたとおり8回膜貫通型であり,追加の膜貫通ヘリックス(TM0)は,通常のロドプシンで見られるような7回膜貫通部位と細胞外ループを通してつながっていた。
膜貫通部位は,結晶構造中では二量体を形成していたが,このTM0は二量体界面に存在しているわけではなかった。このTM0について,全長Rh-PDEからTM0を欠失させた変異体を作製し,発現量や光活性を評価したところ,この変異体は野生型に比べて低い発現量や光活性を示し,TM0は発現量や光活性に大きな役割を果たしていることが示唆された。
さらに,膜貫通部位と酵素部位がどのように相互作用しているのかを解明するため,膜貫通部位と酵素部位をつなぐリンカー部位を含んだような膜貫通部位,酵素部位の構造も決定し,膜貫通部位からまっすぐヘリックスが伸びてリンカーになっていること,酵素部位も二量体を形成しておりリンカーはその二量体界面からつながっていることがわかった。
さらに,リンカー部位全体を構築するために,計算機を使用して構造予測を行なった。これらの構造からRh-PDEの全長構造モデルを構築するために,全長Rh-PDEの高速原子間力顕微鏡(AFM)観察を行なった。この観察結果を踏まえてRh-PDEの全長構造のモデルを構築し,光活性化メカニズムを提唱した。
この研究により,今後,ロドプシンの多様性に関わる研究が進展していくことが期待されるとしている。