 広島大学,神戸大学,大阪大学の研究グループは,動物の網膜桿体細胞内の円板膜において,外界から目に入った光を実際に感知するロドプシンタンパク質が形成する,列状の超分子構造の形成メカニズムを明らかにした(ニュースリリース)。
広島大学,神戸大学,大阪大学の研究グループは,動物の網膜桿体細胞内の円板膜において,外界から目に入った光を実際に感知するロドプシンタンパク質が形成する,列状の超分子構造の形成メカニズムを明らかにした(ニュースリリース)。
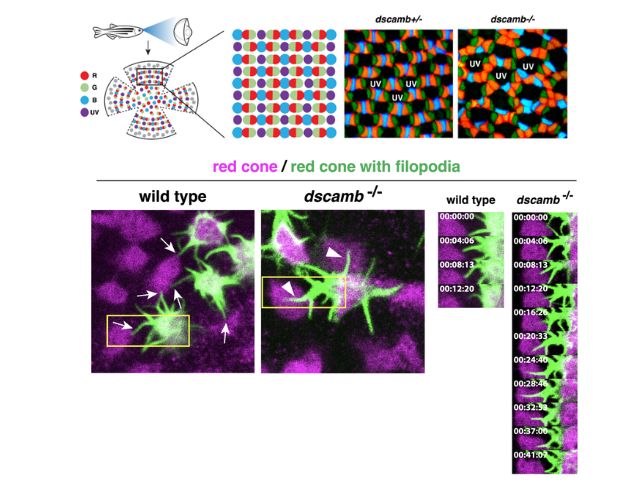
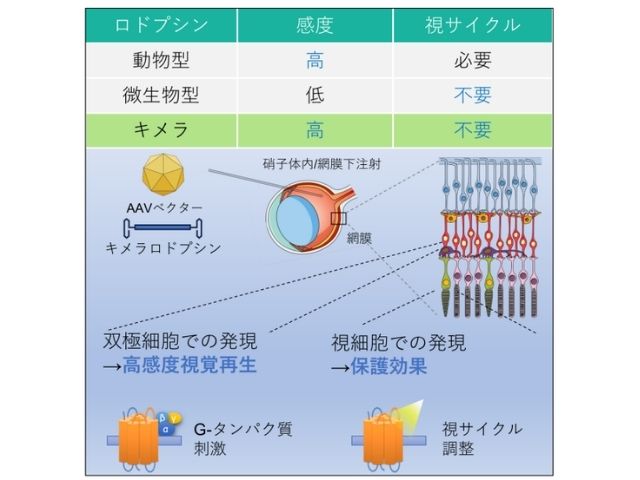
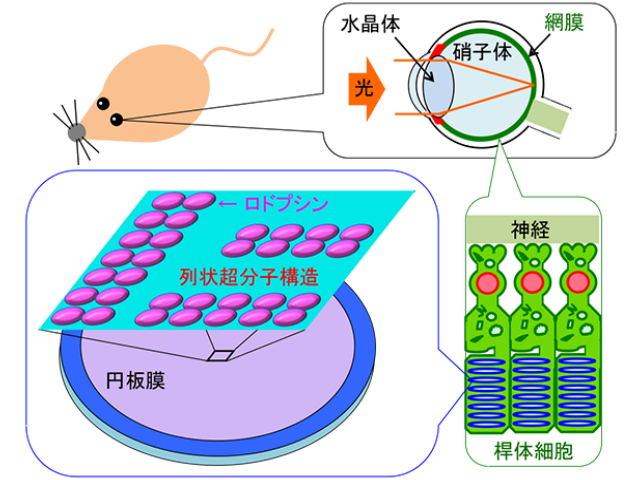
動物の目で光を実際に感知するロドプシンは,網膜内の円板膜で列状超分子を形成している。ロドプシンが存在する円板膜は,多量の不飽和脂質に加え,少量(脂質の8%程度) のコレステロールと飽和脂質から構成されている。
コレステロールと飽和脂質は膜内で脂質ラフトと呼ばれるナノサイズのドメインを形成することが知られ,細胞研究の多くの分野で注目されている。神戸大は,円板膜でのラフトの存在を初めて報告し,その光信号変換での重要性を指摘した。また,ロドプシンの2量体化がロドプシンを劇的にラフト親和的にすることを明らかにしてきた。
さらに最近,円板膜内でロドプシンが0.1µm大で短寿命のラフト領域を自己組織化していることを発見し,ロドプシン超分子構造形成に2量体化依存的ラフト親和性が重要な役割を果たすことを強く示唆した。
しかし2つのロドプシンが互いにどのような向きで結合しているかについての2つのモデル構造を比較すると,強いラフト親和性を持つ部位(ロドプシンの飽和脂肪酸修飾)が,一方では2量体の遠く離れた両端に,もう一方では2量体の中心付近に位置することが分かる。つまりロドプシン2量体とラフトドメインの相互作用の詳細は,両モデル間で全く異なると考えられたという。
そこで広島大は,神戸大及び阪大による実験上の知見に基づいて,上記2種類のロドプシン2量体モデルについて,それらが不飽和及び飽和脂質からなる脂質2層膜に組み込まれた粗視化分子動力学モデルを構成し,動態をシミュレーションした。
その結果,ラフト親和的な部位をその中心付近に持つロドプシン2量体だけが列状超構造を形成し得ることや,ラフトドメインが2量体を繋ぐ「糊」の役を担うことで,長い列状超分子構造が形成・維持されることが明らかになった。
この知見は,ロドプシンと結合し他の分子に光の情報を伝えるタンパク質にとって,この特異な超分子構造がどのような働きをするのかを明らかにする基盤となる。そして脳神経に光の情報を効率よく伝えるメカニズムの理解に繋がっていくという。
またこの研究成果は,膜タンパク質の自己集合に伴うラフト親和性変化が,どのように自己組織化・超分子構造形成に関与するかについて示しており,蛋白質・脂質の動的な自己組織化や局在決定という生体膜研究の未知の領域に重要な手がかりを与えるものとしている。