 東京工業大学,シンガポール科学技術研究庁の研究グループは,膜外にリガンド検出部位を持ち,内部にリガンド結合により活性化する酵素を持つ人工細胞を構築し,外部に存在する抗体などのターゲット分子を高感度に蛍光検出可能な技術の開発に成功した(ニュースリリース)。
東京工業大学,シンガポール科学技術研究庁の研究グループは,膜外にリガンド検出部位を持ち,内部にリガンド結合により活性化する酵素を持つ人工細胞を構築し,外部に存在する抗体などのターゲット分子を高感度に蛍光検出可能な技術の開発に成功した(ニュースリリース)。
近年,臨床診断や食品衛生における病原体検出などの分野において,微小空間で一分子のターゲット由来の信号を検出し,陽性微小空間の数を数えることで,PCR,ELISAなど各種測定の検出感度を飛躍的に向上できるデジタル測定系が注目されている。
しかし,ミセルのような閉鎖空間で反応させて陽性ミセルをカウントするだけでよいPCRと異なり,デジタルELISAにおいては通常のELISAと同様ビーズ上で免疫反応と洗浄を行なったあと,それぞれのビーズを微小空間に分離して酵素反応を行ない,陽性ビーズのカウントを行あう必要があり,手間と時間がかかることから広く普及するには至っていない。
このような洗浄操作が不要で,微小空間で実施可能な抗原・抗体測定法が開発されれば,簡便なデジタル免疫測定系構築の基盤技術となりうる。研究グループは,独自のアイディアをもとに約4年間をかけてこれを実現した。
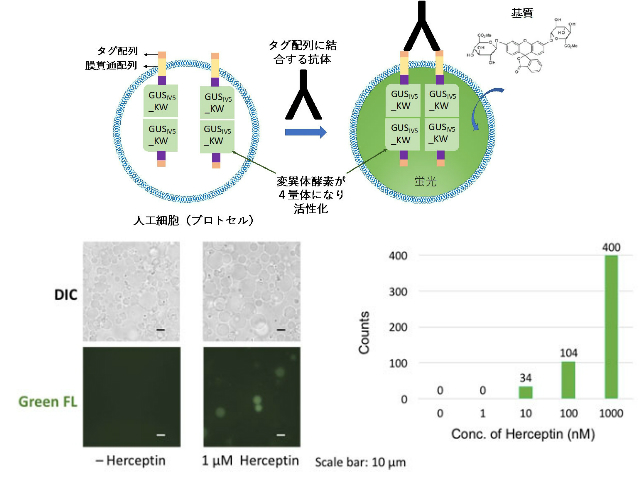
獲得免疫系のB細胞においては細胞表面の受容体で抗原をキャッチし,その信号を細胞内に伝達,分化と増殖を誘導して多数の抗体産生細胞が生じ,抗原の不活化を行なう。これまでこのプロセスを動物細胞あるいは大腸菌で模倣してセンサー細胞化した報告例は数例あるが,人工細胞を用いてこれを実現した例はなかった。
特に今回,遺伝子発現を介さずに受容体型酵素そのものをセンサー化し,酵素活性のOn/Off制御を,膜を介した外部抗体の結合によって行なえたこと,また細胞膜外に抗体断片を含むアダプター分子を加えることによって抗原の検出にも成功した。今後,用いるアダプター分子の抗体断片を変更することにより低分子のみならず病原菌やウィルスなど,多くの抗原検出系を構築できる可能性があるという。
今回構築されたプロトセルは界面透過法によって作られた大きさが不均一な集団であり,このため検出感度もELISAよりやや良い程度に留まっている。今後はプロトセルの大きさと内部のセンサーたんぱく質量をより均一にし,アダプター分子の構造についても最適化してデバイス上に効率よくアレー化することによって,FACSを用いる必要のない迅速高感度な検出系が実現できるとしている。