東京工業大学の研究グループは,ヒストンタンパク質(真核生物のクロマチン(染色体)を構成する主要なタンパク質)の特定の翻訳後修飾(ヒストンH3タンパク質の9番目リジンのアセチル化:H3K9ac)を生細胞内の蛍光色変化として可視化する技術を開発した(ニュースリリース)。
細胞内でDNAと結合しているヒストンタンパク質の翻訳後修飾は,遺伝子の働きを制御する重要な役割を果たしている。その中でヒストンH3のアセチル化修飾は遺伝子活性化の目印として働くと考えられており,発生や分化,iPS細胞(人工多能性幹細胞)の形成過程で大きく変動することが知られていたが,これまで生きた細胞内でその修飾量の変化を蛍光色で観察する技術は報告されていなかった。
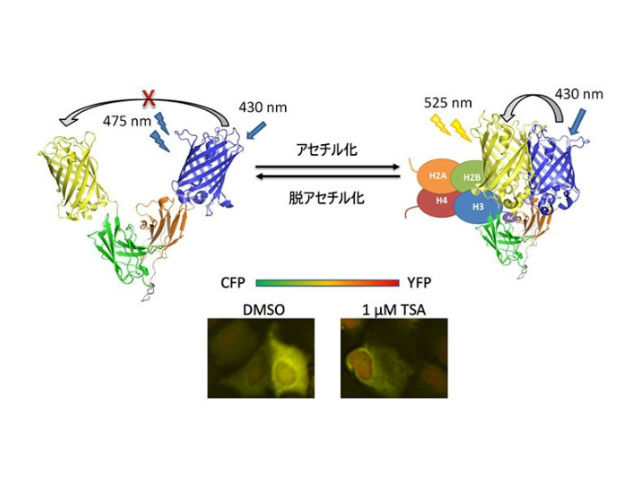
今回の研究では,ヒストンH3タンパク質9番目リジンのアセチル化(H3K9ac)特異的抗体の可変領域を,両側に蛍光色の異なる2種類の蛍光タンパク質を融合させた一本鎖可変領域抗体(scFv)として細胞に発現させ, 蛍光共鳴エネルギー移動型細胞内抗体プローブ(FRET-mintbody)を作製した。
研究グループは,哺乳動物細胞内とその細胞抽出液を用いて構築したFRET-mintbodyがH3K9acに,特異的に結合して蛍光色を変化させることを確かめた。さらに,生細胞内でのH3K9acレベルのカラーライブイメージングに成功した。
この結果,同条件での蛍光観察において,mintbodyの細胞内局在変化よりも大きな色(2波長での蛍光強度比)変化を,より簡便かつ正確に定量することに成功したという。
研究グループは,今回の研究で得られたH3K9 FRET-mintbodyにより,より高い精度で生細胞での解析が可能となり,またこの研究が遺伝子活性化の可視化プローブとして,創薬などへの応用に期待できるとしている。