東京大学と名古屋工業大学は,イタリアのシエナ大学などとの国際共同研究により,ロドプシンのアミノ酸を改変することで,従来より長波長の光で操作が可能な新しい人工ロドプシンタンパク質を作製することに成功した(ニュースリリース)。
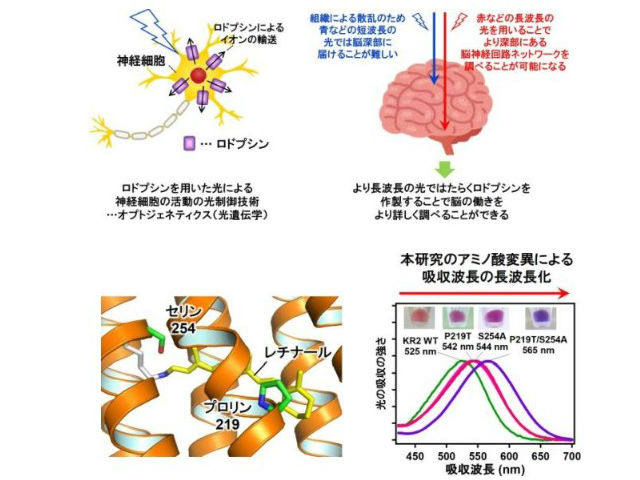
ロドプシンは光のエネルギーを使ってはたらくタンパク質の一種で,動物や微生物の生体内で視覚情報の伝達や,光によるイオンの輸送などを行なっている。近年では,光で脳神経回路を調べる光遺伝学(オプトジェネティクス)技術への応用,さらに視覚再生などの医療応用についても強い注目を集めている。しかし,ヒトを含む動物の生体組織は可視光を強く散乱するため,深部組織へ光を導入することが困難だった。
今回,研究グループは,すべてのロドプシンに存在している,光を受け取る役割を持つレチナールに注目した。レチナールを取り囲むアミノ酸のパターンはタンパク質ごとに異なり,それによって吸収波長が決められている。そこでNa+を輸送するNa+ポンプ型のロドプシンのレチナールの近傍にあるアミノ酸の化学的性質を変えることで,レチナールの持つ電子の状態を制御し,より長波長の光を吸収する分子のデザインを試みた。
その結果,野生型のNa+ポンプ型ロドプシンより40nmも長波長の光で駆動する,これまでにない分子の作製に成功した。吸収波長が大きく変化しているにも関わらず,イオンの輸送能は野生型のNa+ポンプと同等であり,極めて性能のよい分子ツールであることが示された。
また,研究グループは赤外分光法や計算機シミュレーションにより,作製した長波長吸収型のNa+ポンプ型ロドプシンの分子構造と長波長吸収化のメカニズムも明らかにした。
さらに,今回発見された変異によるレチナールの吸収波長の変化は,自然界に存在する特定の細菌の中でも生じていることも明らかにし,自然界で起こるタンパク質の進化についても新たな知見が得られたという。
研究グループは,今回の研究により,深部脳組織に導入したロドプシンを光操作することが可能になり,これまで調べることが困難であった脳神経ネットワークのオプトジェネティクス研究が可能となり,また今後,うつ病などの精神疾患の治療法解明へとつながることが期待できるとしている。