 京都大学,理化学研究所,大阪大学,高輝度光科学研究センターらの共同研究グループは,X線自由電子レーザー(XFEL)施設「SACLA」を用いた「連続フェムト秒結晶構造解析(以下,SFX)」という手法を使い,酵素の一種である「プロテイナーゼK」の構造を原子分解能での解析に成功した」(ニュースリリース)。
京都大学,理化学研究所,大阪大学,高輝度光科学研究センターらの共同研究グループは,X線自由電子レーザー(XFEL)施設「SACLA」を用いた「連続フェムト秒結晶構造解析(以下,SFX)」という手法を使い,酵素の一種である「プロテイナーゼK」の構造を原子分解能での解析に成功した」(ニュースリリース)。
XFELは試料への照射時間が10フェムト秒以下という超短時間のため,タンパク質が壊れる前の微結晶の回折イメージを検出できる。このX線レーザーの特性を利用したタンパク質の構造決定法として,SFXが注目されている。SFX ではインジェクター(噴出装置)から噴出させた多数の微小結晶を含む試料にXFELを照射し,各結晶からの回折イメージを連続的に収集する。
SFXは常温で解析を行なうことができるため,従来の低温条件下(100K,-173℃)で行なう実験とは異なり,生理条件(生体内)に近く,常温で放射線損傷の影響がない構造が得られることや,フェムト秒~ピコ秒の高い時間分解能で構造解析が可能であるという利点がある。
研究グループはこれまでSFXによる様々な手法を確立しているが,原子分解能での精度の高い構造解析には成功していない。今回共同研究グループは,X線自由電子レーザー施設「SACLA」の高エネルギーX線を用いた連続フェムト秒結晶構造解析によって,プロテイナーゼKという酵素の「現時点」では唯一の原子分解能構造解析に成功した。
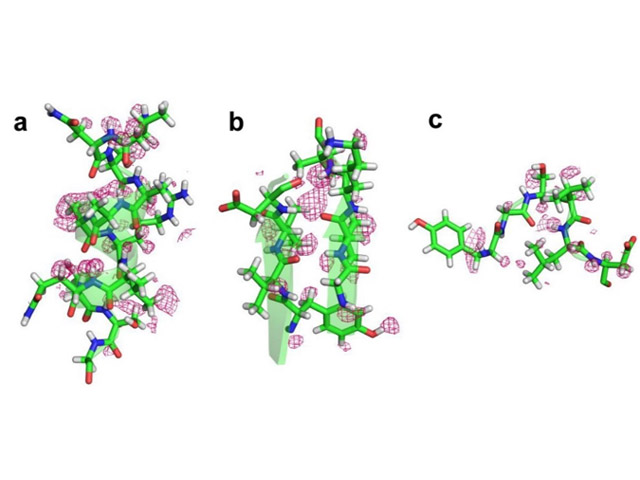
プロテイナーゼKの微結晶(8-12μm)をセルロース媒体と混合し,SACLAの優位点である高エネルギーX線(13keV)を用いてSFX実験を行なった。その結果,82,000枚の回折イメージを収集し,1.20Åの分解能で構造決定を行なうことができた。
この解析により,常温で「水素原子」の可視化にも成功した。またSPring-8に於いて,凍結低温条件下での単結晶構造解析も行ない,今回SFXで得られた構造と相違点があるか検討した。活性部位の構造は比較的似ていたが,近傍の水分子の配置が異なっていた。また常温特有の「タンパク質側鎖の動き」も確認できた。非凍結結晶の解析結果との比較でも,これまで見出されていなかった部位での「水分子の存在」が今回明らかになった。
高分解能結晶構造解析は放射線による試料の損傷を防ぐため,急速に結晶を凍結する手法やX線の照射位置を順次変えるような手法を用いて行なわれているが,凍結処理を行なうことによる弊害も知られている。また凍結に伴いタンパク質分子表面の水分子の配置やタンパク質の側鎖構造が変化し,タンパク質内部にも影響を及ぼすことも指摘されていた。
そのため人為的な影響が少なく,生理的な温度下での精度の高い構造情報が,タンパク質-リガンド間の精緻な相互作用解析に有益な知見を与える。今回の成果で得られた技術や手法を用いて,常温特有のタンパク質や水分子の動き,酵素反応機構を明らかとすることで,医薬品や機能性素材の設計開発など,幅広い応用利用が期待されるとしている。