 慶應義塾大学と東京大学の共同研究グループは,ホタルの発光酵素であるルシフェラーゼを利用した独自の検出システムによって,生きた動物の体内で発生する微量の活性酸素を検出することに世界で初めて成功した(ニュースリリース)。
慶應義塾大学と東京大学の共同研究グループは,ホタルの発光酵素であるルシフェラーゼを利用した独自の検出システムによって,生きた動物の体内で発生する微量の活性酸素を検出することに世界で初めて成功した(ニュースリリース)。
多くの生物が消費している酸素の一部は,代謝過程において活性酸素と呼ばれる高い反応性を持つ物質に変換されるが,活性酸素が大量に発生する状況下では十分に処理しきれないことがある。こうした過剰な活性酸素は癌や生活習慣病,老化等,さまざまな病気の原因であると言われている。
活性酸素は無色透明で発生してもすぐに消えてしまうので,簡単に見ることができない。そのため,活性酸素が発生する場所や量を知ることが難しく,生体内での役割には未だ不明な点が多いため,その働きを評価する手法が必要だった。特に,活性酸素を生きた動物の体内で視覚的に観察することが求められていた。
研究では,同グループが近年見出した電子移動のコントロールによる発光 ON/OFF 制御法を用いて,強い酸化力を持つ活性酸素種(hROS: highly Reactive Oxygen Species)と反応することで強い蛍光を発する性質を持つ蛍光プローブの開発に成功しており,この原理を用いてhROSの検出が可能な生物発光プローブを開発することができるのではないかと考えて研究を行なった。
最初に,ホタルの発光基質である類縁体に,発光酵素であるルシフェラーゼとの出会いと,基質内の電子の遷移を制御できる2つの化学スイッチを同時に導入した。その結果,hROS存在下での発光を,hROS非存在下での発光と比較して極めて大きく増幅できることを示した。
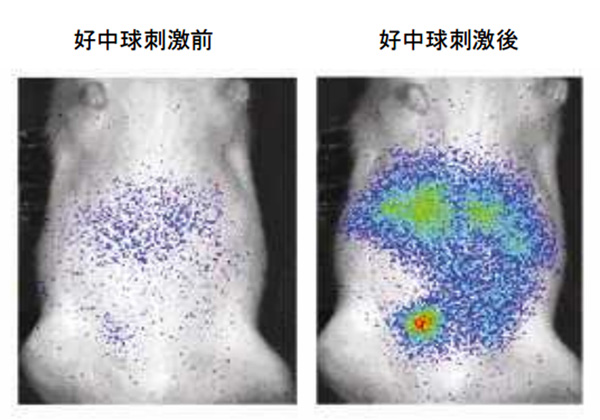
これを用いて,遺伝子導入ラット(通称;ホタルラット4)の深部において免疫細胞の一種である好中球から発生するhROSを高感度に生体内イメージングすることに成功した。
生物発光分子は,発光酵素と反応することで励起状態となり,これが基底状態である非活性化状態に戻るときに光子を放出する。
まず,電子移動のコントロールによる発光 ON/OFF 制御法を用いて,hROSとの反応前には発光が電子移動によって抑制され,hROSとの反応後には発光が回復する,生物発光プローブ(APL)の開発に成功したが,生理学的に意味のある量のhROSを高感度に検出することは困難だった。
そこで,電子移動のコントロールによる発光 ON/OFF 制御法に加えて,生物発光基質がホタルラットの細胞内のルシフェラーゼと出会わないと発光しないことに注目した。第二の ON/OFF スイッチとしてhROSの反応前には細胞膜を透過しにくい一方で,反応後には細胞膜透過性を獲得してルシフェラーゼとの出会いが促進されるように,基質の構造に改変を加えた。
その結果,生体深部で好中球から発生するhROSを生体を傷つけることなく外部から高感度で検出することに成功した。遺伝子導入ラットに好中球誘引物質を腹腔に投与した後に,好中球刺激物質を投与することで好中球から発生するhROSをラットが生きたままの状態で,体外から検出することに成功した。
ホタルラットに今回開発した新型プローベを注入しておいた状態に,好中球から活性酸素を出させることで知られているプロテインキナーゼ活性剤PMAを腹腔内に入れると10分前後で強い発光が出てくることで証明された。
この研究によって病的状態における活性酸素の動態や,ルシフェラーゼを発現するラットから分離し
た幹細胞を用いた細胞移植における種々の変化を見ることができると考えられるという。
この研究成果は,未だ不明な点が多い活性酸素の生体における発生の程度の測定が可能なことから,これまで漠然と活性酸素の発生を抑えると考えられてきた健康食品の科学的立証や新薬の開発に貢献すると期待できるとしている。
関連記事「東北大、活性酸素の強力な消去物質を発見」「北大ら,脂質の可視化にレーザーを用いて成功」「芝浦工大,アメフラシの脳神経活動を可視化」





























