 東京理科大学の研究グループは細胞を生きたままで,細胞内の組織や器官を区別して瞬時にイメージングする技術の開発に成功した(ニュースリリース)。人類共通の課題である食の生産性を高める微細藻類の大量培養や細胞の癌化メカニズムの解明に貢献するとしている。
東京理科大学の研究グループは細胞を生きたままで,細胞内の組織や器官を区別して瞬時にイメージングする技術の開発に成功した(ニュースリリース)。人類共通の課題である食の生産性を高める微細藻類の大量培養や細胞の癌化メカニズムの解明に貢献するとしている。
超解像蛍光顕微鏡は,回折限界を破る高分解能を実現した画期的な技術だが,細胞内の特定の組織や器官を観測したい場合,蛍光標識が生理機能に影響を与えかねないこと,観測領域全体のレーザ走査や多数の画像の取得が必要なために測定時間がかかるといった欠点がある。そこで,蛍光標識なしで生きたままの細胞内の組織や器官を瞬時にイメージングする技術が求められていた。
そこで,吸収スペクトルによる細胞イメージングが実現すれば,ラベル不要の非侵襲イメージングとなる。また吸収スペクトルは発光スペクトルよりも電子励起状態の詳しい情報を持っているため,その違いから細胞内の器官や組織を区別することができる。
しかし,マイクロスケールの領域を透過する微弱光の吸収による減光をS/Nよく測定するのは,微弱な発光を測定するよりもはるかに困難であるために,過去にほとんど例はなかった。
また,蛍光ラベルを必要としない細胞イメージング法として(非線形)ラマンイメージング法があるが,フェムト秒レーザなど高価な光源と観測領域のレーザ走査,そして高感度計測技術が必要となる。また得られる情報は分子振動で,細胞の癌化メカニズム解明につながる電子状態の情報を得るものではない。
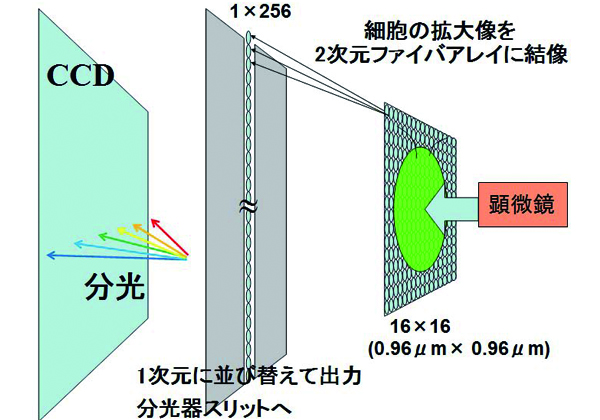
研究グループは,光源にレーザでなく白色光ランプを用いて,生きたままの細胞内の吸収スペクトル分布A(x,y,λ)を瞬時にイメージングする技術を開発した。具体的には,
①2次元-1次元変換バンドルファイバアレイ(ファイバ60μmピッチ,イメージ結像側16×16,分光器スリット側1×256)を導入し,細胞吸収分光イメージを一度に2次元CCD検出器にmappingする。
②収差なしに長い縦幅(18mm以上)で結像できる分光器と大面積(2048×2048pixels,pixel size 13.5×13.5μm2)のCCDを導入して,取得時間0.05秒の無走査吸収分光イメージング法を実現した。
すなわち,10μm×10μmの領域の各点(1μm×1μmの空間分解能)の吸光度スペクトルA(x,y,λ)を0.05秒(シャッターの性能で制限)で測定することが可能となった。
これにより,大きさ約8μmの単細胞緑藻クラミドモナスの細胞内吸収スペクトル分布の測定,クロロフィル吸収の背景の中にある約1μmの細胞内小器官である眼点の吸収スペクトルの直接測定,培養槽内で鞭毛運動により100 μm/sで遊泳中の緑藻細胞1匹の吸光度測定,などを実現している。
現状では観測スペクトル領域は380nmから750nmの主に可視光領域に限定されるので(顕微鏡の透過スペクトル領域で制限されている),葉緑体を持つ植物細胞に適しているが,研究グループでは透明な動物細胞にも適用できるように紫外領域への拡張を検討している。
これにより,例えば癌細胞の紫外吸収イメージングによる識別や吸収スペクトルから電子状態の変化を知ることで,癌化のメカニズム解明につなげたりする応用分野が期待できるとしている。
関連記事「オリンパスら,細胞内微細構造の高速観察法を開発」「理研ら,脂質の分布をラマン散乱顕微鏡で観察」「東工大ら,ファイバレーザを用いた二光子励起蛍光顕微鏡を実現する色素を開発」






























