 岩手医科大学と昭和大学,長岡技術科学大学,宇宙航空研究開発機構(JAXA)らの研究グループは,多剤耐性菌や歯周病菌のペプチド代謝に重要な役割を果たす酵素と非常によく似た構造と機能を持つペプチド分解酵素 DAP BIIを,国際宇宙ステーション(ISS)「きぼう」日本実験棟において結晶化させ,得られた結晶のX線結晶構造解析により,その立体構造とペプチド分解機構を解明した(プレスリリース)。
岩手医科大学と昭和大学,長岡技術科学大学,宇宙航空研究開発機構(JAXA)らの研究グループは,多剤耐性菌や歯周病菌のペプチド代謝に重要な役割を果たす酵素と非常によく似た構造と機能を持つペプチド分解酵素 DAP BIIを,国際宇宙ステーション(ISS)「きぼう」日本実験棟において結晶化させ,得られた結晶のX線結晶構造解析により,その立体構造とペプチド分解機構を解明した(プレスリリース)。
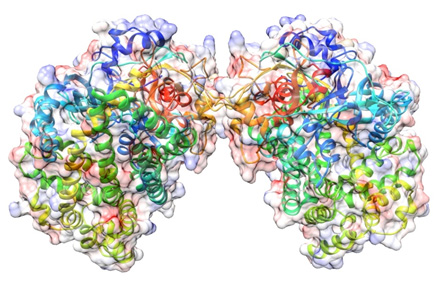
ファミリーS46ペプチダーゼに属する酵素は,人間に似たような酵素がなく,糖非発酵性細菌においてペプチド代謝に重要な酵素であることが知られている。今回,ファミリーS46ペプチダーゼに属する酵素として世界初となるDAP BIIの立体構造を明らかにした。
その結果,ファミリーS46ペプチダーゼの立体構造はこれまでに知られていない全く新規の構造を持っていることがわかった。また,これらの分解酵素の働きを止める物質である阻害剤の開発には,酵素と化合物との相互作用を知ることが重要だが,その相互作用の解明に重要な,分解産物とDAP BIIとの複合体の構造を得ることにも成功した。
これらの立体構造から,ペプチドを分解するメカニズムと基質を認識する仕組みを明らかにした。この構造を基にして,ファミリーS46ペプチダーゼに特異的に結合する阻害剤の設計が可能となる。さらに,DAP BII単独とDAP BIIと分解産物との複合体の立体構造は大きく異なることがわかった。
今後,今回の成果をもとに,多剤耐性菌等の病原性細菌に効果のある阻害剤の設計及び化合物スクリーニングを通じて,新規抗菌薬の開発を目指す。
ISS「きぼう」日本実験棟で結晶化することで,地上での結晶化では3.4Å分解能のデータしか取得できなかったDAP BIIの結晶品質が大幅に改善し,1.95Å分解能のデータ収集が可能となった。この宇宙実験で得られた高分解能のデータは,DAP BIIとペプチドの結合によって生じる構造変化の解明に大きく貢献した。





























