科学技術振興機構(JST)課題達成型基礎研究の一環として、慶應義塾大学教授の長谷耕二氏(理化学研究所客員主管研究員/東京大学医科学研究所非常勤講師)らは腸管の免疫細胞が腸内細菌と共生するために必須の分子をマウスの実験で明らかにした。(ニュースリリース)
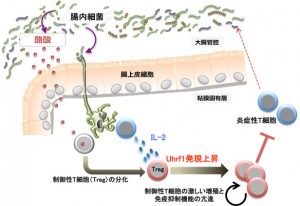
ほ乳類の胎児は母体内では無菌状態だが、ヒトでは出生後直ちに100兆個にも及ぶ膨大な数の細菌にさらされる。生後の無菌環境から腸内細菌が定着する際には、過剰な免疫応答を抑えるための強力な免疫制御システムが働くと考えられている。免疫応答を抑制する細胞として、制御性T細胞が知られている。しかし、どのような機構で制御性T細胞が活性化し、病理的な炎症が抑制され、腸内細菌と宿主免疫系の共生関係が構築されるのかは長い間不明だった。
長谷教授らは、無菌状態から腸内細菌が定着する際、大腸の制御性T細胞内のUhrf1の発現量が高まることをマウスにおいて発見した。さらに、T細胞においてのみUhrf1遺伝子が欠損したマウス(Uhrf1欠損マウス)では、制御性T細胞が増えなくなり、その結果、免疫抑制機能が弱く慢性大腸炎を発症した。
このことから、Uhrf1分子は大腸の制御性T細胞が増殖し働く上で必須であることが分かり、宿主免疫系と腸内細菌が共生関係を築く重要なメカニズムが明らかになった。また、今回の成果は、腸内細菌と免疫系のバランスの不均衡によって発症すると考えられている炎症性腸疾患の病態解明や新たな治療法の開発に向けた基礎的知見として役立つものと期待される。