横浜市立大学大学院生命ナノシステム科学研究科教授の足立典隆氏らの研究グループは、独自の手法で構築した特殊なヒト細胞を利用して、低線量の放射線によって傷つけられた細胞DNAがどのような仕組みで元通りに修復されるのか、そのメカニズムの一端を明らかにした。
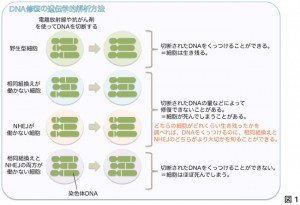
DNAは活性酸素などの内的な要因、あるいは放射線や紫外線、抗がん剤、喫煙などの外的な要因によって頻繁に傷つけられており、特に二本鎖DNAの切断は「最も深い傷」、つまり直されなければ細胞が死に至る(あるいはがん化する)傷である。二本鎖DNA切断を修復する機構には大きく2つの種類があり、一つが相同組換え、もう一つが非相同末端連結(NHEJ)である。
この研究では、遺伝子ターゲティングと呼ばれる特殊な手法を使い、相同組換えとNHEJの一方、または両方を欠損したヒト遺伝子改変細胞を世界で初めて人為的に作製した。こうした変異株細胞に放射線を照射し、生き残ってくる細胞集団(コロニー)の数を調べることで、どのような遺伝子が二本鎖DNA切断の修復に重要なのか、その必要性や重要度を知ることができる。
これにより、NHEJを欠損した細胞は、放射線に対して高い感受性を示す(死滅しやすい)ことがわかった。さらに解析を進めた結果、NHEJではたらく酵素「DNAリガーゼ4」や「アルテミス」を失った細胞では、相同組換えの頻度が上昇していることも明らかになった。以上のことから、細胞に二本鎖切断が生じるとまずNHEJによる修復が試みられ、これに失敗すると相同組換えに切り替えられている可能性が強く示唆された。
さらに、抗がん剤によってDNAが切断された際にもNHEJによる修復が優先的に行なわれており、アルテミスがこの機構に関わっていることを突き止めた。切れたDNAの端っこを整える酵素と考えられてきたアルテミスが、NHEJから相同組換えへの切り替えにも関わっているというのは予想外の発見。
ヒト細胞に生じた二本鎖DNA切断が修復される仕組みの詳細が明らかになることで、放射線治療や抗がん剤治療の技術向上、すなわち、より効果的で副作用の少ない治療法の開発に役立つ。
詳しくはこちら。