基礎生物学研究所・統合神経生物学研究部門教授の野田昌晴氏の研究グループは、受容体型タンパク質チロシン脱リン酸化酵素(RPTP)のR3サブファミリーに属する分子群が、多数の受容体型タンパク質リン酸化酵素(RPTK)を基質分子とし、それらの活性を制御していることを見出した。RPTKは生体内の情報伝達において重要な役割を果たしており、RPTKの異常によって癌や成人病などの様々な疾患を発症することが知られている。
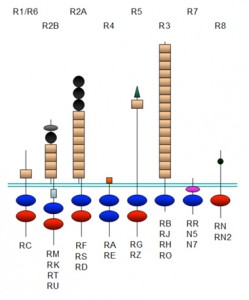
R3 RPTPサブファミリーはPtpro,Ptprb,PtprjおよびPtprhの4つのRPTPから構成される。今回研究グループが、独自に開発したスクリーニング系により,84種類の組み合わせの中から,これら4つのRPTPの基質になるRPTKを探索し結果、30種類の酵素-基質関係を見出すことに成功した。
これらのうち25が新しい酵素-基質関係の組み合わせであった。また、あるRPTKは4つのRPTP全ての基質となるのに対して、別のRPTKは4つのRPTPのうち1つあるいは2つのみの基質となることが分かった。このように、同一のサブファミリーに属するRPTP間にも基質特異性の違い(基質分子の違い)があることが明らかになった。
ランダムに選び出した酵素-基質関係にあるRPTPとRPTKの組み合わせについて、培養細胞を用いて確認実験を行った結果、全ての酵素-基質関係が実際に成立していることが確認された。また、特に重要なこととして、R3 RPTPの発現量や活性を変化させることで、RPTKの活性およびその情報伝達を制御することが可能であることが分かった。
今回の成果は、R3 RPTPサブファミリー分子の生理機能を明らかにする上での重要な基盤となるとともに、R3 RPTPサブファミリーの活性制御を通して、それらの基質となるRPTKの活性を制御するという新しい技術の開発につながるもの。
詳しくはこちら。