東京大学 大学院新領域創成科学研究科教授の佐々木裕次氏を中心とする研究グループは,変性してしまったタンパク質分子を修復する機能を持つシャペロニンタンパク質分子の内部運動を,1分子でリアルタイムに高精度計測することに初めて成功した。
シャペロニンは構造の壊れたタンパク質と直接相互作用し,その折れたたみを促進させるタンパク質。ATP依存的な構造変化によって機能するが,その反応機構は,真核生物の細胞質や古細菌に存在するグループII型シャペロニンにおいては明らかではなかった。
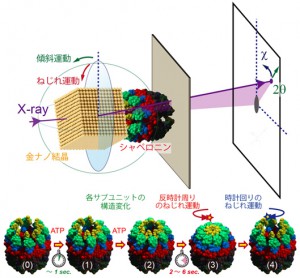
今回,シャペロニンは8量体のリング構造が2つ重なったシリンダ構造をとるが,ATP(アデノシン三リン酸)と結合した後にリング内の一部が構造変化し,その後,リング全体で同期した反時計方向へのドミノ倒しに似たねじれ運動を伴って,開状態から閉状態へ移行することがわかった。
これらの一連の運動は,1998年に佐々木教授が考案し開発したX線1分子追跡法(DXT)を用いて,30ミリ秒の時間分解能で,ピコメートルの位置決定精度で計測された。今までは静止画として何枚も撮影して一連の運動を予測していたが,実時間で見ることで,分子内部運動にどのような協同性があるかを定量的に議論できることが明確となった。
シャペロニンリング内およびリング間の協同性を論じる上で,1分子内部の運動を明確化することは極めて重要。生物系で一番重要と言われるアロステリック効果が,究極的な精度で定量的に初めて議論できることになり,その考案者であるジャン・ピエール・シャンジュー教授(仏国パスツール研究所)も非常に注目している。現在すでに,上下ドメインの協同性の詳細解析や,他の巨大複合体タンパク質分子や,注目される多くのチャネル分子への適用を進めている。
分子生物学では今まで,分子は構造を持った静止体(点)として認識してきた。しかし,今回計測した分子内部運動という新しい物性を高速高精度計測することで,今後,創薬の戦略指針や分子間相互作用の考え方が全く違ったモノになる可能性もある。
例えば,鍵と鍵穴のような創薬ではなく,機能発現に必須な分子運動のみを阻害する「分子内運動阻害分子」の設計が重要になる。この新規創薬分子が非常に機能依存であればあるほど,薬剤による副作用効果激減への新しい戦略となることが期待できる。
詳しくはこちら。